









 Rada pro výzkum, vývoj a inovace: Seznam recenzovaných neimpaktovaných časopisů vydávaných v ČR
Oficielní časopis České společnosti pro ultrazvuk v porodnictví a gynekologii.
Rada pro výzkum, vývoj a inovace: Seznam recenzovaných neimpaktovaných časopisů vydávaných v ČR
Oficielní časopis České společnosti pro ultrazvuk v porodnictví a gynekologii.

Cíl studie: Retrospektivní analýza přínosu jednotlivých segmentů screeningu vrozených vad s využitím vyšetření volné DNA v mateřské plazmě (NIPT) a vytvoření modelu kontingentního NIPT screeningu na základě výsledku kombinovaného testu v I. trimestru (FTS).
Materiál a metody: Z celkem 460 prenatálních nálezů v období 2017 – 2019 jsme u 161 trizomií č. 21 (T21) a 53 trizomií č. 18 (T18) hodnotili podíl výsledků FTS, NIPT, integrovaného testu a ultrazvukových (UZ) nálezů ve II. trimestru na indikacích. Výsledky 24 052 FTS ve stejném období jsme rozdělili do tří kontingentů: 1) s rizikem > 1/100, ultrazvukovým nálezem nebo atypií markerů (vysoké riziko - indikace invazivního vyšetření), 2) s rizikem v rozmezí 1/100 – 1/500 (intermediární riziko - indikace NIPT) a 3) s rizikem v rozmezí 1/501 – 1/2 500 (střední riziko - indikace integrovaného testu).
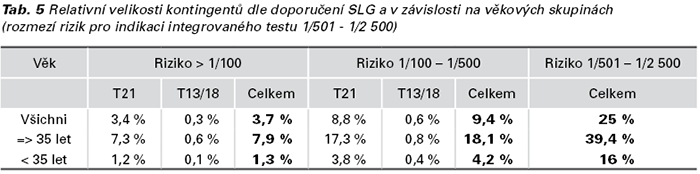
Výsledky: U 161 případů T21 bylo 85 % diagnóz indikováno vysokým rizikem FTS, 7,5 % pozitivním výsledkem NIPT, 4,5 % výsledkem integrovaného testu a 3 % ultrazvukovým nálezem. Z 53 případů T18 byl FTS indikací u 77 %, výsledek NIPT u 6 %, integrovaný test u 2 % a ultrazvukový nález u 15 %. 3,8 % výsledků FTS bylo v kontingentu s vysokým rizikem, 9,4 % s intermediárním rizikem a 25 % se středním rizikem. Více než 25 % ze všech 460 prenatálních nálezů by nebylo možno NIPT zachytit.
Závěr: FTS a ultrazvuk v I. a II. trimestru s následným invazivním vyšetřením těhotných s vysokým rizikem zůstávají základními nástroji prenatální diagnostiky i v případě plošné implementace NIPT v současném standardu. Naše výsledky mohou pomoci pro nastavení plošného kontingentního NIPT screeningu u nás.
Neinvazivní prenatální screening vrozených vad pomocí volných fragmentů kyseliny deoxyribonukleové (cfDNA) umožnilo zjištění, že cfDNA v plazmě těhotných je směsí tvořenou DNA z apoptotických mateřských buněk (průměrně 90 % cfDNA) a buněk trofoblastu (průměrně 10 % cfDNA) (1). K detekci cfDNA v mateřské plazmě a výpočtu relativního zastoupení fragmentů příslušejících ke sledovaným chromozomům a klinicky významným oblastem genomu se používají různé laboratorní a statistické metody využívající rychlého vývoje molekulárně genetických metod a počítačové techniky (2,3,4,5,6). Od doby klinické implementace roku 2012 bylo podáno dostatek důkazů o vysoké efektivitě neinvazivního prenatálního testování pomocí cfDNA (NIPT) a jeho limitujících a korigujících faktorech (7,8). Současné metody NIPT významně ovlivnily způsob prenatálního screeningu častých aneuploidií - trizomií chromozomů č. 21 (T21), č. 18 (T18) a č. 13 (T13) (9,10). Metody NIPT pro screening aneuploidií pohlavních chromozomů, subchromozomální deleční a duplikační varianty počtu kopií (CNV) nebo prenatální diagnózu monogenních chorob (NIPD) se vyvíjejí a současné názory na jejich implementaci jsou kontroverzní (11,12).
Kontingentní NIPT screening zaměřený na časté aneuploidie je jednou ze strategií inkorporující NIPT do screeningového systému častých aneuploidií (13,14). Naše modifikace kontingentního NIPT screeningu vychází z doporučení Společnosti lékařské genetiky a genomiky (SLG) k indikaci NIPT (15) a doporučení k provádění diagnostických prenatálních vyšetření (16). Základním screeningovým vyšetřením je kombinovaný test v prvním trimestru (FTS), jehož výsledky rozdělují těhotné do tří skupin (kontingentů):
U všech těhotných doporučujeme expertní ultrazvukové vyšetření ve 20. – 22. týdnu. Invazivní vyšetření je doporučeno vždy při ultrazvukovém nálezu a pro konfirmaci výsledků NIPT.
V 2017 – 2019 bylo v laboratořích GENNET vyšetřeno celkem 886 biopsií choria (CVS), 3 028 amniocentéz (AMC) a 3 920 NIPT a diagnostikováno celkem 460 závažných chromozomálních nálezů, jejichž distribuce je uvedena v Tab. 1. Část vzorků byla transportována z jiných pracovišť (převážně ze Sanus Hradec Králové, ÚPMD Praha a FTN Praha). Pro odhad přínosu jednotlivých kontingentů pro prenatální diagnózu častých aneuploidií (T21, T18, T13) jsme použili podskupinu 161 případů T21, které byly geneticky konzultovány na klinikách GENNET a 53 případů T18, u kterých byla známa indikační kritéria. U případů T13 se známými indikačními kritérii byla indikace k diagnóze vždy na základě výsledků FTS. T13 byla proto z této analýzy vyjmuta. Ve sledovaném období bylo na všech klinikách GENNET (Praha, Liberec) a spolupracujícím prenatálním centru Gynekologie MUDr. Brožek, s.r.o. Ústí nad Labem provedeno celkem 24 052 FTS. Část těhotných byla doporučena k FTS nebo genetické konzultaci na klinice GENNET po záchytu na jiném pracovišti. Z výsledků FTS jsme odhadli velikosti jednotlivých kontingentů a jejich ovlivnění věkem.

V rámci kontingentního testu bylo provedeno 3 920 NIPT. Výsledky jsou uvedeny v Tab. 2 a 3. Okrem alterácie hormonálneho metabolizmu estrogénov sa podieľa na znížení inzulínovej rezistencie, priaznivo ovplyvňuje metabolizmus glukózy (6). Vďaka týmto vlastnostiam je I3C predmetom skúmania pri liečbe syndrómu polycystických ovárií (PCOS) (19).


Komentář k Tab. 2 a 3: Iniciální pozitivita (IPR) udává část pozitivních nálezů NIPT, které vyžadují konfirmaci invazivním vyšetřením. Část invazivně konfirmovaných trizomií na základě výsledku NIPT udává pozitivní prediktivní hodnota testu (PPV).
Odhad přínosu jednotlivých segmentů kontingentního screeningu pro diagnózu T21 a T18 podle příslušnosti ke kontingentům na základě výsledků FTS je uveden v Tab. 4.

Komentář k Tab. 4: Trizomie 21 (celkem 161 případů): 85 % případů bylo v kontingentu s vysokým rizikem, 7,5 % případů v NIPT kontingentu a 7,5 % případů v kontingentu II. trimestru (4,5 % výsledky integrovaného testu s rizikem FTS < 1/500, 3 % ultrazvukový nález).
Trizomie 18 (celkem 53 případů): 77 % případů bylo v kontingentu s vysokým rizikem, 6 % případů v NIPT kontingentu a 17 % případů v kontingentu II. trimestru (2 % výsledky integrovaného testu s rizikem FTS < 1/500, 15 % ultrazvukový nález). Výsledek NIPT předcházel diagnostickému prenatálnímu vyšetření u 3/53 případů T18 (6 %). U všech tří případů však byl pozitivní ultrazvukový nález (edém plodu, růstová retardace, meningokéla) a NIPT bylo provedeno spíše z psychologické indikace. U dalšího případu T18 indikovaného podle doporučení nebyl výsledek NIPT vydán pro nízkou fetální frakci a následná indikace k AMC byla provedena na základě UZ nálezu ve II. trimestru.
Retrospektivní stanovení velikosti screeningových kontingentů: Relativní velikost screeningových kontingentů byla stanovena z výsledků 24 052 FTS provedených na klinikách GENNET (průměrný věk těhotných žen 32,5 roku v termínu, 37 % žen ve věku 35 let a více, 120 případů T21, 31 případů T18, 13 případů T13) a jejich ovlivnění věkem těhotné – viz Tab. 5.
Naše výsledky potvrzují úlohu NIPT v kontingentním screeningu hlavně pro diagnózu T21. U trizomií T18 a T13 byly prakticky všechny indikace k diagnostickému vyšetření buď v kontingentu s vysokým rizikem FTS nebo na základě ultrazvukového nálezu. Při vysokém riziku FTS nebo ultrazvukovém nálezu indikace NIPT s velkou pravděpodobností oddálí a prodraží prenatální diagnózu. U prenatální diagnostiky T21 a T18 jsme potvrdili již dříve publikovaný význam integrovaného testu (20). V našem souboru bylo 4,5 % diagnóz T21 a 2 % diagnóz T18 indikováno výsledky integrovaného testu s rizikem FTS < 1/500.
NIPT je součástí prenatálních screeningových programů v řadě zemí většinou v kontingentní strategii, pouze v Holandsku (NL) a Belgii (B) je NIPT univerzálním prenatálním testem s přibližně 50% (NL) a více než 75% (B) utilizací (21). Kontingentní NIPT screening je ekonomicky přijatelnější alternativou se zachováním vysoké detekce častých aneuploidií a snížením invazivních výkonů. Gil et al. (13) uvádí v populaci 11 692 těhotných s průměrným věkem 31 let 3,9 % s rizikem > 1/100 indikovaných k invazivnímu vyšetření a 30,4 % v rozmezí rizik 1/100 – 1/2 500 indikovaných k NIPT s očekávanou detekcí 97 % T21 a 95 % T18 a T13. Wald et al. (14) uvádí ve skupině 22 812 těhotných (medián 31 let, věkové rozmezí 28-35 let) celkem 10 % těhotných indikovaných k NIPT s rizikem FTS vyšším než 1/800 a detekci 95 % T21 a 96 % T18. Kontingenty ve švédské populační studii Iwarssona et al. jsou 4,5 % těhotných s rizikem FTS > 1/200 a 10,2 % s rizikem v rozmezí 1/200 – 1/1 000 (129 493 těhotných, průměr 32 let, 33 % starších 35 let) (22). Výsledkem naší modelové strategie tří kontingentů je kromě 3,8 % výsledků FTS s vysokým rizikem také zpřesnění indikace k NIPT pomocí výsledků integrovaného testu u 25 % vyšetřených s rizikem FTS v rozmezí 1/501 – 1/2 500 (kontingent II. trimestru). Očekávaná iniciální pozitivita integrovaného testu v této rizikové skupině je nižší než 2 %, což představuje méně než 0,5 % screenovaných FTS, které by doplnily primární NIPT kontingent přibližně na 10 % všech screenovaných.
Pozitivní prediktivní hodnota NIPT pro T21 (59 %) a T18 (50 %) byla v našich výsledcích nižší, než je většinou udáváno (23). Hlavním důvodem nižší PPV při NIPT v našem souboru byla kromě zvýšeného základního rizika v NIPT kontingentu (1/100 – 1/500) i určitá opatrnost při hodnocení výsledků. NIPT také nebylo indikováno vždy podle doporučení, především z důvodu ohledů na přání těhotné – část indikovaných k invazivnímu vyšetření výkon odmítla a část indikovaných k NIPT vyžadovala invazivní vyšetření s kompletní informací včetně výsledku CMA. V praxi to ale znamenalo iniciální pozitivitu v kontingentu NIPT a tím i konfirmační invazivní vyšetření pouze u 1,8 % testů (67/3 712).
Pokud vezmeme v úvahu vrozené vývojové vady (VVV), které vedly k spontánnímu potratu nebo umělému přerušení těhotenství a vady s pozdní manifestací, je možno odhadnout prevalenci všech VVV plodu až u 6 % těhotenství. Přibližně u poloviny z nich (u 3 % těhotných) jsou vady plodu multifaktoriální etiologie, často s morfologickým nálezem, 0,5 – 1 % plodů má mikroskopickou chromozomální vadu, 1 % má subchromozomální CNV a 0,5 – 1 % plodů je postiženo monogenní vadou. Časté aneuploidie tedy tvoří přibližně třetinu VVV s prokazatelnou genetickou etiologií, z toho přibližně polovina (celkem 15 % vad) připadá na trizomii chromozomu 21. Současná prenatální genetická diagnostika musí počítat i s klinicky významnými subchromozomálními CNV detekovanými pomocí CMA a vadami způsobenými s mutacemi v jednom genu (monogenní) detekovanými většinou sekvenováním nové generace (NGS) z materiálu plodu. Pro tuto skupinu vad s významným podílem nových mutací stále zůstávají hlavními indikátory rizika FTS nebo integrovaného testu, expertní ultrazvukový nález v I. a II. trimestru nebo významná atypie biochemických markerů FTS. U těchto VVV nemůže současné NIPT konkurovat metodám přímého vyšetření tkání plodu (11,12) i přes rychlý vývoj nových technik NIPT (30). Riziko CNV plodu není ovlivněno věkem těhotné a frekvence klinicky významných CNV u plodů bez prokázané morfologické vady a s normálním klasickým karyotypem je 0,5 – 1,3 % (24). Pravděpodobnost nálezu klinicky významné CNV se zvyšuje při nálezu morfologické vady plodu – CNV jsou prokazovány navíc u 5 – 10 % vyšetřovaných plodů s mnohočetnými vadami a normálním karyotypem (25). V našem materiálu přineslo vyšetření choriové biopsie pomocí CMA u těhotných s významným rizikem FTS závažný nález CNV navíc u 6 % indikovaných. U skupiny AMC s širším spektrem indikací (např. věk, anxiozita, výsledek integrovaného testu, mužský faktor) byly závažné CNV diagnostikovány u 2 % vyšetřených. Celkem CNV představovaly 25 % všech závažných nálezů prenatální diagnostiky. I když u heterogenní skupiny CNV není možné odhadnout část spontánně potracených plodů během dalšího průběhu těhotenství, je pravděpodobné, že poměr CNV k častým aneuploidiím u narozených dětí by byl ještě vyšší. Evans (26) uvádí, že u mladších těhotných je 10x vyšší riziko nálezu CNV než časté aneuploidie zjistitelné pomocí současné NIPT. Použití NIPT jako screeningového testu první volby v Holandsku sice zvýšilo detekci častých aneuploidií spolu se snížením počtu invazivních výkonů, ale došlo k významnému snížení prenatální detekce CNV (10,11). Pro optimální detekci všech atypických chromozomálních nálezů (až 55 % očekávaných) doporučuje Iwarsson (22) invazivní vyšetření u těhotenství s rizikem FTS > 1/200. V dánské studii (27) byla většina CNV diagnostikována ve skupině rizik FTS 1/100 – 1/300.
Dalším zpřesněním prenatální diagnostiky je klinicky dostupné vyšetření exomu (WES) z materiálu plodu zaměřené na mutace v protein kódujících oblastech genomu, které jsou příčinou až 85 % monogenních VVV. Lord et al. (28) uvádí další nárůst nálezů významných genových variant při WES u 8,5 – 15,4 % plodů se strukturálními vadami. Při dostatečné hloubce sekvenace je možné při WES detekovat i varianty počtu kopií (CMV) s vyšší citlivostí (~ 40 Kb) než většina současných CMA. Teoreticky je možné pomocí WES detekovat CNV na úrovni jednoho exonu (~ 200 bp) a samozřejmě i chromozomální aneuploidie a jejich mozaiky. Při optimalizaci doby vyšetření (cca 7 – 10 dní) se může rychlý WES (rWES) stát prenatálním diagnostickým testem první volby (29).
Kontingentní NIPT screening a navazující diagnostická prenatální vyšetření podle doporučení SLG (15,16) vytváří spolu s expertním ultrazvukovým vyšetřením efektivní systém prenatální diagnostiky. Kontingent NIPT obohacený výsledky integrovaného testu tvořil v našem modelu přibližně 10 % vyšetřených FTS. U části těhotenství s nejvyšším rizikem častých aneuploidií vyšetřené invazivně (přibližně 4 % výsledků FTS) byly zjištěny další vady nezachytitelné NIPT, které představovaly 25 % všech prenatálně diagnostikovaných nálezů. Vývoj prenatální diagnostiky směřuje ke zvýšení prahu citlivosti NIPT na subchromozomální a genovou úroveň, k vyšetření kolujících fetálních buněk a klinické implementaci prenatálního rWES.
| AMC | amniocentéza |
| bp | pár bází DNA |
| cfDNA | volná DNA |
| CMA | chromozomální microarray |
| CNV | varianty počtu kopií |
| CVS | biopsie choria |
| DNA | kyselina deoxyribonukleová |
| FTS | kombinovaný screening prvního trimestru |
| IPR | iniciální pozitivita |
| Kb | tisíc párů bází DNA |
| MoM | násobek mediánu |
| NGS | sekvenování nové generace |
| NIPT | neinvazivní screening s využitím cfDNA |
| NIPD | NIPT zaměřený na monogenní mutace |
| PPV | pozitivní prediktivní hodnota |
| QFPCR | kvantitativní fluorescenční polymerázové reakce |
| SLG | Společnost lékařské genetiky a genomiky |
| T21 | trizomie chromozomu č. 21 |
| T18 | trizomie chromozomu č. 18 |
| T13 | trizomie chromozomu č. 13 |
| UZ | ultrazvuk |
| WES | celoexomové sekvenování |
| rWES | celoexomové sekvenování v rychlém režimu |