








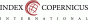

 Rada pro výzkum, vývoj a inovace: Seznam recenzovaných neimpaktovaných časopisů vydávaných v ČR
Oficielní časopis České společnosti pro ultrazvuk v porodnictví a gynekologii.
Rada pro výzkum, vývoj a inovace: Seznam recenzovaných neimpaktovaných časopisů vydávaných v ČR
Oficielní časopis České společnosti pro ultrazvuk v porodnictví a gynekologii.

Chromozomové aberace jsou častou příčinou časných reprodukčních ztrát. Možnou přítomnost chromozomové aberace je možné ověřit cytogenetickým vyšetřením tkáně potraceného plodu. V rámci naší studie na Ústavu biologie a lékařské genetiky 1. lékařské fakulty Univerzity Karlovy a Všeobecné fakultní nemocnice v Praze jsme analyzovali vzorek tkáně u 233 případů časných spontánních či zamlklých potratů. Ve 212 případech byla kultivace úspěšná a celkem v 52 případech (24,5 %) byla zachycena chromozomová aberace – nejčastěji trizomie chromozomu 21, monozomie chromozomu X, triploidie a trizomie chromozomů 16 a 22. Celková četnost chromozomových aberací byla v našem souboru spíše nižší oproti obdobným studiím. I s ohledem na další ukazatele předpokládáme, že by příčinou mohla být kontaminace některých vzorků mateřskými buňkami, což ale nelze u rutinního cytogenetického vyšetření předem vyloučit. Dále jsme v rámci studie potvrdili vyšší četnost chromozomových aberací v případech s vyšším věkem matky a dále pak častější zastoupení chromozomových aberací v případech potratu ve vyšších týdnech těhotenství. Tyto nálezy byly statisticky významné.
Z čistě matematického hlediska je lidská reprodukce poměrně neefektivní. V rámci studií bylo prokázáno, že s ohledem na veškeré možné patologické vlivy, které ovlivňují lidské embryo/plod od počátku fertilizace až do doby porodu, se živě narodí asi jen 30 % dětí ze všech oplozených vajíček (1). Opakované spontánní potraty (dle definice končí potratem alespoň tři po sobě jdoucí gravidity – a to se stejným partnerem) postihují přibližně 1-2 % žen v reprodukčním věku (2). Obecně mají časné reprodukční ztráty v prvním trimestru gravidity celou řadu příčin, mezi ty negenetické by patřily například endokrinologické či imunologické abnormality, vrozené či získané hyperkoagulační stavy či vrozené malformace dělohy (3).
Pokud jde o genetické příčiny, jsou jednoznačně nejčastější příčinou časných reprodukčních ztrát chromozomové aberace, a to zejména aberace numerické. Chromozomové aberace mohou být příčinou přibližně až poloviny časných reprodukčních ztrát, v různých studiích s různým počtem/typem vzorků tkáně potracených plodů byly abnormality chromozomů zachyceny u 20 – 70 % případů (4,5,6,7).
Základním typem cytogenetického vyšetření v této indikaci je rutinní karyotypizace kultivovaných buněk ze vzorku tkáně potraceného plodu, tedy vyšetření metafázních chromozomů barvených pomocí tzv. G-pruhování v optickém mikroskopu (4). Toto vyšetření je schopné detekovat veškeré numerické odchylky chromozomů, včetně chromozomální mozaiky, balancovaných chromozomových přestaveb a také rozsáhlejších delecí a duplikací. Ovšem právě v detekci drobných delecí a duplikací je klasické vyšetření karyotypu často pro svou nízkou rozlišovací schopnost ne zcela výtěžné, proto i v této indikaci (vyšetření tkáně potraceného plodu) je dnes stále častěji prováděno vyšetření typu microarray (nejčastěji ve verzi vycházející metodicky z principu komparativní genomové hybridizace array-CGH) (8,9).
Předkládáme retrospektivní analýzu případů vyšetření karyotypu z tkáně u potracených plodů, které byly vyšetřeny v rámci Cytogenetické laboratoře Ústavu biologie a lékařské genetiky 1. lékařské fakulty Univerzity Karlovy a Všeobecné fakultní nemocnice v Praze (ÚBLG 1. LF UK a VFN) v letech 2009-2014 (6 let). Případy byly vybrány z interní databáze laboratoře, zahrnuty byly všechny případy za toto období, kde byl indikací k vyšetření karyotypu zamlklý či spontánní potrat. U každého případu jsme zaznamenali úspěšnost kultivace, výsledek karyotypu (u úspěšných kultivací), věk těhotné, gestační týden při potratu a také pohlaví plodu (určené dle karyotypu). Získané výsledky byly následně statisticky vyhodnoceny v programu R (10) pomocí dvouvýběrového t-testu, Wilcoxonova dvouvýběrového testu a Fisherova testu. P-hodnota nižší než 0,05 byla považována za statisticky významnou.
Samotná cytogenetická vyšetření byla provedena standardním způsobem s využitím obvyklých metodik pro vyšetření karyotypu ze vzorku tkáně, k vizualizaci chromozomů bylo využito G-pruhování, další vyšetření (například QF-PCR nebo array-CGH) nejsou v této indikaci v naší laboratoři rutinně prováděna. Zhodnocení karyotypu bylo provedeno s využitím mezinárodní cytogenetické nomenklatury (11).
V daném období (2009-2014) bylo v rámci Cytogenetické laboratoře ÚBLG 1. LF UK a VFN v Praze vyšetřeno celkem 233 vzorků tkáně plodu z důvodu reprodukční ztráty (zamlklé či spontánní potraty), většina případů byla odeslána z Gynekologicko-porodnické kliniky 1. LF UK a VFN v Praze. Z těchto 233 vyšetření jich bylo celkem 212 úspěšných (91 %) – zakončených vydáním výsledku karyotypu, ve zbylých 21 případech (9 %) pak šlo o neúspěšnou kultivaci a vyšetření tak neposkytlo validní výsledek. Hlavním důvodem k cytogenetickému vyšetření tkáně plodu byla diagnóza zamlklého potratu, a to ve 214 případech (91,9 %), méně často pak byla vyšetřována rezidua tkáně po spontánním potratu (19 případů, 8,15 %).
Mezi 212 úspěšnými vyšetřeními bylo zachyceno celkem 52 (24,5 %) patologických chromozomových aberací, nejčastěji byl zachycen Downův syndrom a Turnerův syndrom – obě diagnózy celkem v 7 případech, kompletní přehled dalších zachycených chromozomových aberací ukazuje Tab. 1.
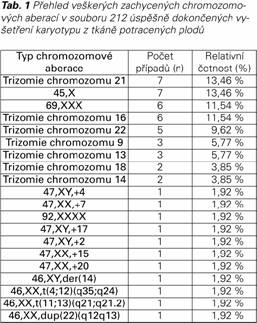
Průměrný věk těhotných žen byl 34,06 roku (± 5,03 SD). Nejčastěji byly vyšetřovány plody potracené ženami ve věku 35 let a více, v této skupině bylo také zaznamenáno nejvyšší procento zachycených patologických karyotypů (29,9 %). Ve skupině žen do třiceti let věku byla záchytnost chromozomových aberací o třetinu menší (20,0 %) – podrobněji jsou data shrnuta v Tab. 2. Závislost věku matky a výskytu numerické aberace byla vyhodnocena dvouvýběrovým t-testem a ukázala se být statisticky významná: p = 0,022 (95% CI pro rozdíl: 0,28 až 3,50). Další sledovanou proměnnou byla délka gravidity v době, kdy došlo k potratu. Dle příslušných klinických zpráv byla průměrná délka trvání gravidity v době potratu vypočtena na 72,87 dne (± 18,75 SD). Rozložení četnosti případů vzhledem k délce gravidity v době potratu se ovšem u patologických a normálních nálezů poměrně liší – maximum případů u patologických nálezů se vyskytuje řádově o několik dní později, nežli u nálezů normálních. Graficky je tento trend znázorněn na Grafu 1, statistická významnost tohoto trendu pak byla testována pomocí Wilcoxonova dvouvýběrového testu a zjištěna byla statisticky významná závislost (p = 0,0000041).
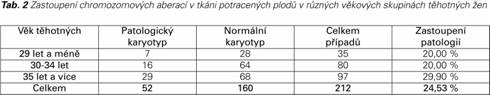
Graf 1 Rozložení četnosti případů potratů v závislosti na délce gravidity (v době potratu) – rozděleno pro patologické a normální nálezy
Posledním trendem, který jsme podrobněji analyzovali, byl poměr pohlaví u vyšetřovaných plodů. Z 212 úspěšných vyšetření bylo celkem 169 plodů s ženským karyotypem a 43 plodů s karyotypem mužským (F/M poměr = 3,93). Zatímco ve skupině plodů s patologickým nálezem je (teoreticky rovnoměrný) poměr pohlaví bez významnější odchylky: 26 patologií u ženského karyotypu a 22 u mužského karyotypu (F/M = 1,18), ve skupině plodů s normálním karyotypem je tento trend naopak velmi výrazný: 143 případů s ženským karyotypem ku 21 případům u mužského karyotypu (F/M = 6,81). Dle Fisherova testu je také tento rozdíl pohlaví statisticky významný ( p = 0,000003), možné příčiny tohoto trendu jsou podrobně rozvedeny v diskuzi.
Problematika lidské reprodukce a jejích poruch je velmi komplexní a složitá. Souvislost chromozomových aberací u embryí a plodů a časných reprodukčních ztrát je dlouhodobě známá. I v našem souboru bylo nalezeno významné zastoupení chromozomových abnormalit – celkem 24,5 %. Takovéto zastoupení je sice v rozmezí hodnot udávaných jinými obdobnými studiemi, v porovnání s průměrně udávanými přibližně 50-60 % patologických výsledků (5,6,12,13), je naše záchytnost výrazně nižší. Mezi zachycenými patologiemi jsme nalezli obvyklé spektrum numerických chromozomových aberací, přítomných ve tkáni potracených plodů – tedy vyšší procento Turnerova syndromu, trizomie chromozomu 16 a chromozomu 22 a dále i několik případů polyploidie (konkrétně triploidie). Nejvzácnější autozomální trizomie – trizomie chromozomů 1 a 19 (5) nebyly v našem souboru zachyceny. Možná překvapivě bylo zachyceno i vysoké procento trizomie chromozomu 21, což může být způsobeno skutečností, že významná část vzorků byla z tkání plodů potracených až po 11. týdnu gravidity, kdy již obecně lze více očekávat vyšší zastoupení tří „klasických“ autozomálních trizomií (tedy trizomií chromozomů 13, 18 a 21).
V našem souboru byl jednoznačně významně vychýlený poměr pohlaví u vyšetřovaných vzorků, a to konkrétně v podskupině případů s normálním karyotypem, kde byl F/M poměr dokonce 6,81. Přestože i jiné práce (5) připouští například poměr 1:2 ve prospěch ženského pohlaví, lze takovýto statisticky významný rozdíl prohlásit za následek vyššího zastoupení maternální kontaminace, kdy se z daného vzorku tkáně podařilo vykultivovat pouze maternální buňky, které pak falešně imitují nález normálního ženského karyotypu. Obecně by bylo možné tomuto nežádoucímu fenoménu předcházet pomocí doplnění QF-PCR vyšetření s kontrolou maternálního profilu, pokud by bylo klinikem indikováno. Na druhou stranu bylo dosaženo velmi vysokého procenta úspěšnosti kultivace (téměř 92 %), kterou by ale v rámci podrobnější studie s vyloučením kontaminovaných vzorků bylo nutné upravit. Obecným problémem je v této situaci samozřejmě obtížná dostupnost vhodného vzorku v případech spontánního potratu.
Výtěžnost klasického vyšetření karyotypu by bylo možné rozšířit doplněním vyšetření typu microarray, které by umožnilo zachytit i další procenta chromozomálně podmíněných potratů, které však rutinní vyšetření chromozomů v optickém mikroskopu nemá šanci odhalit (8,9). Obecně lze jistě doporučit provedení microarray vyšetření zejména v případě opakovaných potratů při negativitě klasického cytogenetického vyšetření, na druhou stranu by ale nemělo vyšetření typu microarray zcela nahradit rutinní karyotypizaci tkáně potraceného plodu, neboť vyšetření typu microarray nedokáže například správně identifikovat translokační formy trizomií a má rovněž obtíže při identifikaci nízkofrekvenční mozaiky, array-CGH navíc nedokáže často identifikovat triploidii (14).
V rámci naší studie se nám dále podařilo prokázat negativní vliv rostoucího věku matky na četnost chromozomálních odchylek, kdy u případů s vyšším věkem matky byly chromozomové abnormality nacházeny častěji (tento trend byl statisticky významný). To je v souladu s nálezy jiných autorů (např. 7). Dále se nám podařilo prokázat statisticky významný trend závislosti předpokládaného gestačního týdne a přítomnosti/nepřítomnosti patologie. V nižších týdnech těhotenství při potratu jsme nalezli významně menší zastoupení chromozomových aberací oproti vyšším týdnům.
Potvrdili jsme, že chromozomální aberace, detekovatelné v optickém mikroskopu, jsou významnou příčinou zamlklých a spontánních potratů u člověka. Dále jsme zjistili, že i u potratů se projevuje známá závislost rostoucí četnosti chromozomových aberací se zvyšujícím se věkem těhotné ženy. Stáří gravidity u plodů, u kterých byla po potratu identifikovaná chromozomová aberace, bylo mírně vyšší, nežli u potratů, kde byl karyotyp plodů normální. Zároveň jsme ukázali, že i přes veškerou snahu je v některých případech vyšetření karyotypu plodu z dodaného vzorku tkáně limitováno možností kontaminace maternální tkání, která je při použití samotné karyotypizace jen velmi obtížně odhalitelná, a výhodnější by bylo její vyloučení například pomocí metody QF-PCR. Na druhé straně, rutinní cytogenetické vyšetření je v této oblasti stále nedocenitelné, neboť nejen v řadě případů přinese informaci pro rodiče, proč k potratu došlo, přičemž v určitých případech (translokační formy Downova syndromu, jiné strukturní aberace) může mít tato informace i důležitý přínos pro plánování další reprodukce páru.
Práce byla podpořena grantem MZ ČR – RVO VFN64165.