








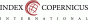

 Rada pro výzkum, vývoj a inovace: Seznam recenzovaných neimpaktovaných časopisů vydávaných v ČR
Oficielní časopis České společnosti pro ultrazvuk v porodnictví a gynekologii.
Rada pro výzkum, vývoj a inovace: Seznam recenzovaných neimpaktovaných časopisů vydávaných v ČR
Oficielní časopis České společnosti pro ultrazvuk v porodnictví a gynekologii.

Ovariálny hyperstimulačný syndróm predstavuje hoci zriedkavú, ale o to závažnejšiu iatrogénnu komplikáciu indukcie ovulácie počas metód asistovanej reprodukcie, spojenú s významnou morbiditou a potenciálnou mortalitou. Kľúčovú úlohu vo vzniku tohto syndrómu zohráva vaskulárny endotelový rastový faktor, ktorý vedie k zvýšenej vaskulárnej permeabilite s následným presunom intravaskulárnej tekutiny do kompartmentov tretieho priestoru. Štúdie preukázali, že podávanie agonistov dopamínu, akým je kabergolín, blokuje zvýšenie vaskulárnej permeability defosforyláciou receptorov vaskulárneho endotelového rastového faktora. Kabergolín tak môže byť podávaný ako účinná prevencia strednej a ťažkej formy ovariálneho hyperstimulačného syndrómu, rovnako ako liečba už rozvinutého ochorenia. V súčasnosti však stále neexistuje štandardizovaný protokol, podľa ktorého by sme mali kabergolín podávať.
Počas fyziologického menštruačného cyklu pred selekciou jediného dominantného folikulu vzniká kohorta nízkeho počtu antrálnych folikulov. Tento proces je riadený mechanizmami spätnej väzby regulačnej osi hypotalamus-hypofýza-ovárium. Počas riadeného stimulovaného menštruačného cyklu vedie podávanie exogénnych gonadotropínov k súčasnému rastu veľkého počtu antrálnych folikulov. Tým sa udržiava ich rast, s cieľom vzniku viacerých dominantných folikulov a dozretia viac ako jedného zrelého oocytu na odber (1).
Indukčná ovulačná terapia je jednou z najdôležitejších procesov pre cykly asistovanej reprodukcie. Počas týchto procedúr je žiaduci určitý stupeň ovariálnej hyperstimulácie, avšak prehnaná odpoveď organizmu predstavuje riziko potenciálne život ohrozujúceho ovariálneho hyperstimulačného syndrómu (OHSS), ktorému sa snažíme vyhnúť (2).
OHSS sa teda považuje za iatrogénny následok indukcie ovulácie počas cyklov in vitro fertilizácie (in vitro fertilization - IVF) pri liečbe neplodnosti (3). Závažný OHSS postihuje asi 1 % všetkých žien, ktoré podstupujú liečbu pomocou techník asistovanej reprodukcie (1).
Rozlišujeme dve formy OHSS. Včasnú, ktorá je spôsobená nadmernou odpoveďou vaječníkov na exogénny ľudský choriový gonádotropín (human chorionic gonadotropin - hCG) a neskorú, spôsobenú nadmerným množstvom endogénneho hCG produkovaným implantovaným embryom (4,5). Skorá forma sa vyskytuje zvyčajne < 10 dní po ovulácii vyvolanej hCG. Je sebalimitujúca v prípade, že nedôjde k otehotneniu. Neskorá forma sa objavuje ≥ 10 dní po odbere oocytov (6).
Zriedkavo sa u mladých pacientok môže objaviť spontánny OHSS, bez iatrogénnej etiológie. Spontánny OHSS bol najčastejšie popisovaný v spojení so syndrómom polycystických ovarií, adenómom hypofýzy vylučujúcim gonadotropín, primárnou hypotyreózou, niekedy aj počas fyziologickej gravidity (7,8).
OHSS sa prejavuje bolesťou brucha, nadúvaním, nevoľnosťou, vracaním, v závažných prípadoch aj dýchavičnosťou a bolesťou na hrudníku (9). Zatiaľ čo mierna forma je klinicky bezvýznamná, ťažká forma je charakterizovaná masívnym zväčšením vaječníkov, pleurálnym výpotkom, ascitom, oligúriou a hemokoncentráciou s tromboembóliou (2). Pacientky s rozvinutým ochorením sú vystavené riziku respiračného zlyhania, zlyhania obličiek a tromboembolickej chorobe, ktorá je hlavnou príčinou morbidity a mortality spojenej s týmto syndrómom (10,11).
Medzi hlavné rizikové faktory rozvoja OHSS patrí syndróm polycystických ovárií, vysoká ovariálna rezerva (zvýšená hladina antimülleriánskeho hormónu), vysoký počet antrálnych folikulov, nízky index telesnej hmotnosti, anamnéza OHSS, vysoká hladina estradiolu v sére, vysoký počet získaných oocytov, rovnako ako nízky vek či gravidita (11).
Efektívna starostlivosť o pacientky s OHSS začína včasnou diagnostikou (4). Hospitalizácia je indikovaná v prípade ťažkej formy s nezvládnuteľným vracaním, bolesťami brucha nereagujúcimi na jednoduché analgetiká, výrazne sa zhoršujúcou abdominálnou distenziou s prítomným ascitom, stupňujúcim dyspnoe, ťažkou oligúriou, úzkosťou pacientky, hypotenziou a synkopami, hyponatriémiou, hyperkaliémiou, hematokritom viac ako 45 % a abnormálnymi hodnotami pečeňových testov (1). Hospitalizované pacientky musia byť intenzívne sledované, pretože sa ich klinický stav môže veľmi rýchlo meniť (6).
Manažment starostlivosti by mal zahŕňať náhradu tekutín fyziologickým roztokom, denné laboratórne kontroly kompletného krvného obrazu, elektrolytov a pečeňových funkcií a tromboprofylaxiu s použitím kombinácie kompresných pančúch, kyseliny acetylsalicylovej a nízkomolekulárneho heparínu alebo nefrakcionovaného heparínu (1). Denne by mala byť zaznamenávaná hmotnosť pacientky a obvod jej brucha (12). Zároveň by mali byť monitorované symptómy, bilancia tekutín, tlak krvi, saturácia kyslíkom, auskultácia hrudníka a palpácia brucha. V prípade oligúrie (< 30 ml/h) by mal byť zavedený permanentný močový katéter a pri podozrení na torziu vaječníkov vykonaný ultrazvuk oblasti malej panvy s dopplerovským meraním (1).
Najčastejším dôvodom hospitalizácie sú príznaky vyplývajúce z ascitu. Punkcia a aspirácia ascitickej tekutiny je indikovaná u pacientok so symptomatickými ťažkosťami, dýchavičnosťou, abdominálnou distenziou a bolesťou alebo oligúriou. Bezprostredne po výkone dochádza k charakteristickým hemodynamickým zmenám vrátane zníženého intraabdominálneho tlaku, zlepšeného venózneho návratu a zlepšenej perfúzie obličiek a maternice (12). Pri ťažkom OHSS s pleurálnym výpotkom môže byť vykonaná torakocentéza s následnou drenážou (13).
Vo veľmi kritických prípadoch by sa malo zvážiť prerušenie včasnej gravidity (6).
Správna individualizácia liečebných protokolov pri IVF je založená na dobrej predikcii ovariálnej odpovede, najmä jej extrémov, a to slabej alebo nadmernej reakcie (14). Pri prevencii OHSS je dôležité rozpoznanie rizikových faktorov a voľba vhodného stimulačného protokolu. Cieľom je zníženie prípadov zrušenia cyklov, vzniku iatrogénnych komplikácií vrátane OHSS a zlepšenie výsledkov techník asistovanej reprodukcie (15). Stimulačné protokoly, ktoré využívajú antagonisty hormónu uvoľňujúceho gonadotropín (gonadotropin-releasing hormone - GnRH) na potlačenie ovulácie sú spojené s nižším výskytom OHSS v porovnaní s protokolmi, ktoré používajú agonisty GnRH. Predpokladá sa, že mechanizmus súvisí so znížením hladín cirkulujúceho estradiolu, ktoré sú pozorované pri supresii antagonistu GnRH (17). U pacientok ktoré reagujú na ovariálnu stimuláciu vysokými plazmatickými hladinami estradiolu môže byť podávanie gonádotropínu znížené alebo pozastavené, pokiaľ sa nedosiahne hladina estradiolu považovaná za bezpečnú, tzv. „coasting“ (2). Riziko OHSS je väčšie u pacientok podstupujúcich riadenú ovariálnu stimuláciu v prípade, ak dôjde k otehotneniu. Zároveň je však toto riziko obmedzené na prípady, kedy došlo k expozícii hCG. Možnosťou zníženia expozície hCG je obmedzenie jeho použitia iba na spúšťaciu dávku, čím by sa zabránilo predĺženej expozícii prirodzeného hCG z tehotenstva. Pri metóde „freeze all“ sú po získaní oocytov všetky oocyty, embryá kryokonzervované a následný transfér prebieha v nestimulovanom cykle (16). Ďalšou a pravdepodobne najúčinnejšou stratégiou prevencie OHSS je nahradenie hCG GnRH antagonistami na spustenie konečného dozrievania oocytov. To zabezpečuje dostatočnú maturáciu oocytov a výrazne znižuje riziko OHSS. GnRH antagonistický spúšťač sa však môže aplikovať iba v protokoloch s využitím antagonistov GnRH, čo predstavuje menšiu skupinu cyklov (6,22). Do úvahy prichádza aj zníženie dávky hCG, čo však riziko neskorého nástupu OHSS neznižuje (6). Ďalšou možnosťou prevencie OHSS je podanie albumínu. Albumín zvyšuje onkotický tlak a pôsobí proti zvýšenej permeabilite vyvolanej angiotenzínom II. Rovnako sa môže viazať aj na vazoaktívne látky, ako sú faktory súvisiace s reninangiotenzínovým systémom a vaskulárnym endotelovým rastovým faktorom (vascular endothelial growth factor - VEGF) (17).
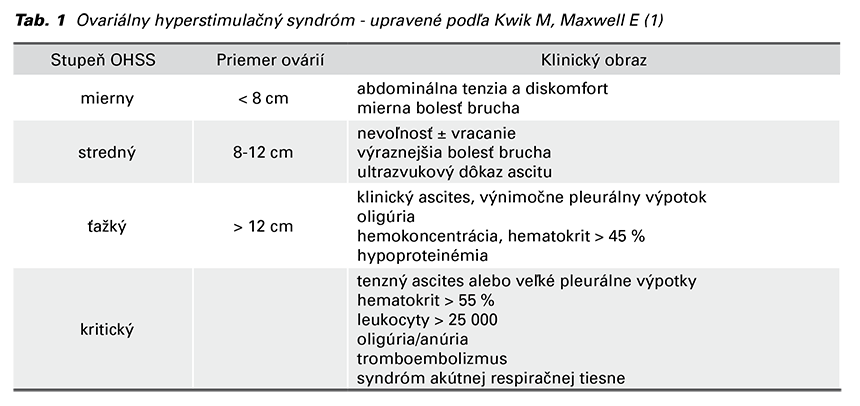
Presný mechanizmus vzniku OHSS stále nie je úplne objasnený. Vyskytuje sa u žien, ktoré sú vystavené stimulácii receptorov luteinizačného hormónu. Až na zriedkavé výnimky, vzniká až po expozícii hCG, ktorý má výrazne dlhší polčas rozpadu ako luteinizačný hormón. Spôsobuje tak rozsiahlu luteinizáciu v granulózových bunkách v corpus luteum. To následne vedie k produkcii vazoaktívnych látok. Najvýznamnejší je VEGF, spôsobujúci zvýšenú vaskulárnu permeabilitu ovariálnych a peritoneálnych kapilár s následnou hemokoncentráciou (17,18).
VEGF, ktorý stimuluje vývoj nových krvných ciev a vaskulárnu hyperpermeabilitu interakciou s jeho VEGF receptorom 2 (VEGFR-2) je pravdepodobne najdôležitejším faktorom vzniku OHSS (19,20). Považuje sa za kľúčový pri indukcii hyperpermeability ovariálnych krvných ciev (21). Nadmerne sa vylučuje ako odpoveď na hCG a jeho väzba na receptor na endotelových bunkách vedie k zvýšenej vaskulárnej permeabilite s postupnými klinickými prejavmi OHSS (Obr. 1) (20,22). Platí, že s vyššími hladinami VEGF sa spája ťažší priebeh tohto ochorenia (3).
Gómez a kol. vo svojej štúdii na hyperstimulovaných potkanoch dokázali, že blokáda VEGFR-2 znižuje vaskulárnu permeabilitu (23). Existuje teda silný konsenzus, že inhibícia expresie VEGF môže redukovať výskyt OHSS (21). Štúdie o VEGF preukázali, že okrem jeho silného účinku na vaskulárnu permeabilitu má dôležitú úlohu vo folikulogenéze a angiogenéze v corpus luteum a endometriu a taktiež zohráva dôležitú úlohu v embryonálnej angiogenéze (22).
Intraovariálny renín-angiotenzínový systém (RAS) je ďalším patofyziologickým mechanizmom podieľajúcim sa na vzniku OHSS. HCG aktivuje RAS, čo je potvrdené asociáciou vysokej aktivity renínu vo folikulárnej tekutine žien s OHSS (3). Medzi ďalšie mediátori zúčastňujúce sa patogenézy patrí angiotenzín II, inzulínu podobný rastový faktor-1 a interleukín- 6 (6).
Začiatkom 90. rokov minulého storočia sa stal dostupným nový agonista dopamínu (23). Kabergolín priamo stimuluje D2-dopamínové receptory a pre jeho vyššiu afinitu k tomuto receptoru, menšiemu počtu závažných vedľajších účinkov a pohodlnejšej dávkovacej schéme oproti zaužívanej liečbe, bromokriptínu, sa používa ako liek prvej voľby v liečbe hypofyzárnych prolaktinómov (25,26,27). Vďaka lepšej tolerancii sa čoraz častejšie používa aj ako účinná farmakologická terapia na zastavenie laktácie v dávke 1 mg do 24 až 48 hodín po pôrode alebo 0,5 mg dvakrát denne do podobu 2 dní (27).
Predpokladalo sa, že liečba agonistom dopamínového receptora, akým je kabergolín, môže viesť k zníženiu produkcie VEGF a následnému zníženiu OHSS.
Existuje rastúci počet dôkazov, ktoré hodnotia podávanie agonistov dopamínu na zníženie závažnosti a výskytu OHSS (17). Viaceré štúdie preukázali, že podávanie kabergolínu môže znížiť výskyt OHSS u vysokorizikových pacientok (28).
Liečbu OHSS pomocou agonistu dopamínu popísali ako prví Ferrarettiho a kol. v roku 1992. Kabergolín bol podávaný 7 pacientkam trpiacim ťažkou formou OHSS. Uviedli regresiu prejavov tohto syndrómu do 48 hodín. Okrem toho, nezaznamenali žiadne nepriaznivé účinky na matku alebo plod. Dospeli tak k záveru, že dopamínová terapia by mohla priniesť prelom v liečbe OHSS (29). Baumgarten a kol. vo svojej metaanalýze zistili, že kabergolín znižuje výskyt stredne ťažkej až ťažkej formy OHSS. Taktiež uviedli, že neexistuje konsenzus o tom, kedy začať a kedy prestať podávať kabergolín alebo v akých dávkach ho podávať (10). Kamat a kol. popísali, že expresia VEGF v ľudských granulózových bunkách začína pred podaním hCG a vrcholí po jeho podaní (30). Na základe toho, Gaafar a kol. podávali vysokorizikovým pacientkam dávku 0,5 mg kabergolínu denne po dobu 8 dní od doby, kedy dominantný folikul dosiahol priemer 15 mm, čo je zvyčajne dva dni pred podaním hCG. Tento spôsob následne vyhodnotili ako účinnú prevenciu (22). Tehraninejad a kol. v randomizovanej kontrolnej štúdii porovnávali perorálne podávanie kabergolínu a intravenózne podávanie albumínu v prevencii OHSS. Zistili, že kabergolín nielen znižuje výskyt a závažnosť tohto ochorenia, ale je aj cenovo výhodnejší a bezpečnejší ako albumín (31). Podľa Cochranovej databázy z roku 2021 agonisty dopamínu, kabergolín, znižujú výskyt stredne ťažkej a ťažkej formy OHSS (32).
Gonadotropíny, lieky, ktoré sa používajú vo všetkých protokoloch ovariálnej stimulácie zvyšujú expresiu VEGFR-2. Po podaní hCG sa jeho hladiny zvyšujú ďalej až na maximum. Hladiny VEGF lineárne korelujú s vaskulárnou permeabilitou. Väzba dopamínu na jeho receptor spôsobuje inhibíciu signalizácie VEGFR- 2, ktorá je závislá od dávky. Okrem toho, vysoká expresia VEGF je spojená so zníženou produkciou dopamínu. Agonisti dopamínu zmenia VEGFR-2 na nedostupný pre VEGF, čím deaktivujú dráhu VEGF/ VEGFR-2, čo následne vedie k zníženiu vaskulárnej permeability (33). Kabergolín teda spôsobuje inhibíciu fosforylácie VEGFR-2 a produkcie VEGF (19,34).
Z animálnych štúdií vieme, že interakcia medzi VEGF a VEGFR-2 je nevyhnutná pre vývoj ovariálnych folikulov do predovulačného štádia a neskôr vo folikulogenéze gonadotropínmi indukovanú angiogenézu (35). To vyvoláva obavy, či podanie kabergolínu nemôže mať nežiaduci negatívny vplyv na dozrievanie oocytov, endometriálnu angiogenézu, implantáciu a mieru gravidity, najmä, ak sa podáva pred odberom oocytov. Avšak hCG, často používaný na spustenie ovulácie v cykloch IVF, zvyšuje hladinu proteínu VEGF zvýšením koncentrácií mRNA VEGF v bunkách ovariálnych granulóz (28).
Podľa Cochranovej databázy z roku 2021 v súčasnosti neexistujú žiadne dôkazy o tom, že by kabergolín ovplyvňoval výsledky gravidity, teda mieru implantácie, gravidity a potratovosti (32). Zároveň neboli doteraz popísané žiadne vedľajšie účinky na matku a plod vo včasných fázach gravidity (34). Ďalšou obavou sú jeho možné dlhodobé účinky na zdravie matky a novorodenca. Zdá sa, že srdcové chlopne, ktoré sú postihnuté u pacientov s Parkinsonovou chorobou v dôsledku liečby agonistami dopamínu, nie sú ovplyvnené dávkou, ktorá sa používa pri OHSS a ktorá je podobná dávke používanej na liečbu pacientov trpiacich prolaktinómom (33).
V súčasnej dobe však stále neexistuje štandardizovaný protokol na podávanie kabergolínu u rizikových pacientok (28). Rôzne štúdie ukázali, že podávanie kabergolínu (0,5 mg/deň) od dňa podania hCG u vysokorizikových žien môže znížiť výskyt a závažnosť včasnej formy OHSS v cykloch IVF s použitím agonistov gonádoliberínov, ale nemôže ohroziť mieru gravidity (19). Podľa Cochranovej databázy bola dĺžka podávania kabergolínu u rôznych autorov rôzna, avšak najčastejšie po dobu siedmych alebo ôsmych dní (32).
Kabergolín sa javí ako účinná profylaktická, rovnako ako aj terapeutická metóda liečby OHSS. Keďže v súčasnosti ešte stále nemáme objasnenú presnú etiológiu OHSS, budú potrebné ďalšie štúdie, ktoré stanovia nie len účinnosť, ale najmä presné dávkovanie s cieľom objasniť tento potenciálny profylaktický a terapeutický potenciál.