








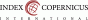

 Rada pro výzkum, vývoj a inovace: Seznam recenzovaných neimpaktovaných časopisů vydávaných v ČR
Oficielní časopis České společnosti pro ultrazvuk v porodnictví a gynekologii.
Rada pro výzkum, vývoj a inovace: Seznam recenzovaných neimpaktovaných časopisů vydávaných v ČR
Oficielní časopis České společnosti pro ultrazvuk v porodnictví a gynekologii.

Kolonizace vaginy a rekta těhotných bakterií Streptococcus agalactiae (GBS) představuje riziko infekce matky, plodu nebo novorozence s potenciálně závažným průběhem a komplikacemi. V České republice je zaveden celoplošný screening na tuto bakterii u všech těhotných žen. Toto sdělení pojednává o prevalenci a citlivosti na antibiotika GBS u gravidních žen. Hodnotili jsme prevalenci kolonizace z let 2013 až 2020. Dále od poloviny roku 2019 začalo testování antibiotické citlivosti u všech GBS pozitivních kultur. Průměrná prevalence GBS vyšla 19,77%. Rezistence na penicilin (ampicilin) odpovídá 0,65%, na klindamycin 15,52% , na erytromycin 20,45% a na vankomycin 0%.
Streptococcus agalactiae neboli GBS (Group B Streptococcus) je β-hemolytická grampozitivní bakterie. Kolonizuje genitál u části gravidních žen a jedná se o nejčastějšího původce perinatální, časné a pozdní neonatální a puerperální infekce (1). Proto všechny těhotné ženy v České republice podstupují screeningový vaginorektální stěr ve 35. - 37. gestačním týdnu (2). V případě pozitivního screeningu se peripartálně podává antibiotická profylaxe především jako prevence časné neonatální infekce. Mezi další indikace aplikace antibiotik patří: anamnéza GBS bakteriurie v současné graviditě, předchozí dítě prodělalo invazivní GBS infekci v novorozeneckém věku, prematurita, odtok plodové vody delší než 18 hodin nebo známky infekce. Antibiotikum první volby je penicilin G i.v., na nějž je dlouhodobě dobrá citlivost. Druhou volbou je cefalosporin 1. generace i.v. (cefazolin), typicky u pacientek alergických na penicilin, jež mají nízké riziko anafylaxe. Těm s vysokým rizikem se podává klindamycin či vankomycin i.v. (ideálně dle známé citlivosti). Naše hypotéza byla, že pro adekvátní zhodnocení rizika je vhodné znát aktuální epidemiologickou situaci v regionu. A na ni jsme se v této práci zaměřili.
V této retrospektivní studii jsme mezi lety 2013 až 2020 hodnotili prevalenci vaginorektální GBS kolonizace gravidních, jež prošly prenatální poradnou Krajské nemocnice Liberec, a.s. Celkem bylo testováno 18 108 kultur, z čehož ve 3 579 případech (což odpovídá 19,77 %) byl vykultivován GBS. Dále od poloviny roku 2019 ve spolupráci s mikrobiologickým oddělením začalo testování ATB citlivosti u všech GBS pozitivních kultur (celkem 700 vzorků). Vzorek populace odpovídá všem ženám, které byly otestovány v rámci GBS screeningu v naší laboratoři. Stěry byly vaginorektální, kultivace probíhala v selektivním mediu určeném pro GBS. Nebylo rozlišováno mezi invazivními a neinvazivními kmeny. Testována byla tato antibiotika: ampicilin, klindamycin, erytromycin, vankomycin.
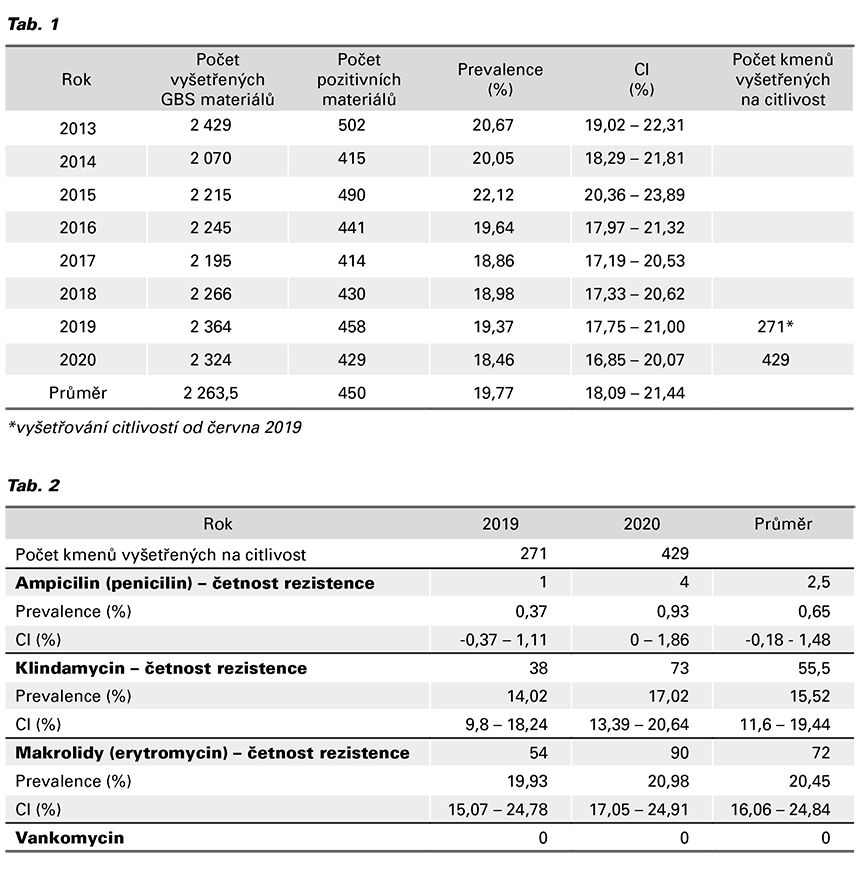
Průměrná prevalence vyšla 19,77 % (3 579/18 108; 95% CI 18,1 - 21,4) (Tab. 1). Rezistence na ampicilin (penicilin) odpovídá 0,65 % (5/700; 95% CI -0,18 - 1,48), na klindamycin 15,52 % (111/700; 95% CI 11,6 – 19,44), na erytromycin 20,45 % (144/700; 95% CI 16,06 – 24,84) a na vankomycin 0 % (Tab. 2).
Problematika kolonizace porodních cest GBS představuje jednu z nejvýznamnějších v současném porodnictví. Prevalence dosahuje v různých zemích průměrně 20 % (8). Tato bakterie je součástí normální flory gastrointestinálního traktu. Má se za to, že právě zde se nachází zdroj kolonizace do urogenitálního traktu. Tato kolonizace může následně vyvolat infekci různé závažnosti, a to močovou, perinatální, časnou a pozdní neonatální a puerperální, případně způsobit intrauterinní odúmrť plodu. Antibiotická profylaxe snižuje pouze incidenci časné neonatální infekce (1). Celosvětově existují dva modely doporučených postupů: „culture based GBS protocol“ (používaný v USA) nebo „risk based GBS protocol“ (používaný ve Velké Británii, Nizozemí nebo na Novém Zélandu) (3). Culture based GBS protocol spočívá ve vaginorektálním průkazu GBS pomocí kultivačních metod mezi 35. a 37. gestačním týdnem. V případě průkazu GBS se aplikují antibiotika. Vyšetření se neprovádí v případě výskytu časné neonatální infekce u předchozího dítěte nebo GBS bakteriurie v současné graviditě a podání antibiotik je indikováno (4). Při použití risk based GBS protocol se antibiotika aplikují při přítomnosti alespoň jednoho z následujících rizikových faktorů: intrapartální febrilie ≥ 38 °C, porod před gestačním týdnem 37+0, odtok plodové vody ≥ 18 hodin, výskyt časné neonatální infekce u předchozího dítěte nebo GBS bakteriurie v současné graviditě (5).
Česká republika má ve svých doporučených postupech zakotveno uplatnění kombinace obou postupů, tj. zohledňujeme výsledek kultivace a zároveň pečlivě sledujeme event. projevy intraamniální infekce během porodu (2). Za pozitivní výsledek přítomnosti GBS chápeme jakýkoliv nález tohoto mikroba z kultivace močových cest a/nebo z vaginálního/vaginorektálního stěru v průběhu těhotenství, a to bez ohledu na to, zdali byl posléze výsledek kultivace z daného tělesného kompartmentu těhotné negativní. Vzhledem k narůstající spotřebě antibiotik je stále naléhavější ověřit, zdali je GBS dostatečně citlivý. V případě rezistence GBS vůči vybranému antibiotiku nemůžeme chápat GBS profylaxi jako dostatečně efektivní. Studium rezistence mikroorganismů vůči antibiotikům je proto v současnosti jedním z hlavních témat v celé medicíně. Citlivost vzorků vyšetřujeme vůči penicilinu, klindamycinu, erytromycinu a vankomycinu. Naše laboratoř využívá k testování citlivosti na makrolidy (respektive na azitromycin, klaritromycin, roxitromycin, erytromycin), což je v souladu s doporučením EUCAST (6,7).
Irská studie z roku 2020 uvádí rezistence na erytromycin v Číně 74 %, v USA 44,8 – 54,8 %, v Itálii 43,75 %, v Irsku 22,5 %. Nejnižší hodnoty byly v Ghaně 1 %, na Islandu 9 %, v Litvě 4,1 % (8). V našem vzorku odpovídala rezistence 20,45 %. Rezistence na klindamycin se pohybují v těchto hodnotách: Taiwan 65,9 %, USA 43 %, Portugalsko 34 %, Alžírsko 43,2 %, Irsko 21,3 %, Ghana 3,1 %, Argentina 1,8 %, Brazílie 2 % (9). V České republice odpovídá rezistence zhruba 30 % (10). V našem vzorku vyšla rezistence 15,52 %. Rezistence na beta-laktamová antibiotika je minimální – v řádu jednotek procent, a to jak v našem souboru vzorků, tak i ve světě. Výjimku tvoří Japonsko, kde z rezistence 2,3 % mezi lety 2005 – 2006 došlo k nárůstu na 68,9 % v letech 2012 – 2013.
Hayes, O’Halloran a Cotter zaznamenaly pouze dva případy rezistence na vankomycin (oba v USA), my žádný.
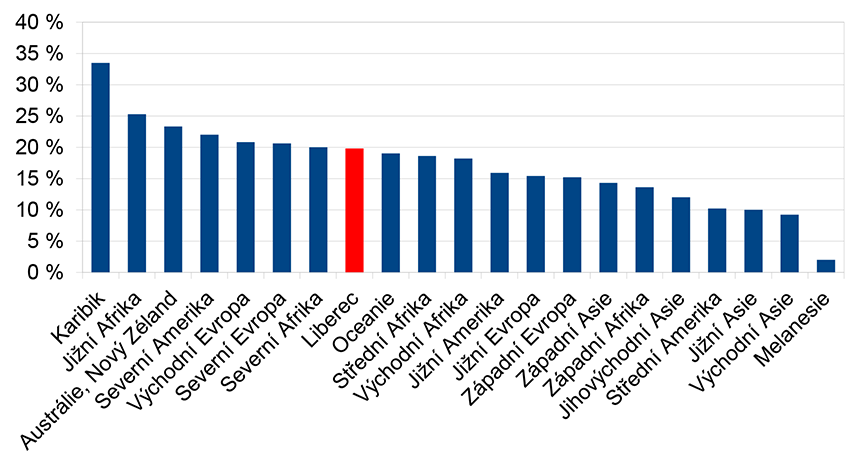
Dle metaanalýzy z roku 2017 (zkoumající data z 85 zemí u téměř 300 000 žen) připadá na východní Evropu prevalence 22,9 %. Průměrná hodnota v rozvinutých zemích (Evropa, Severní Amerika, Austrálie, Nový Zéland) byla 21 %. Celosvětově se data však velmi liší. Zatím, co ve východní Asii dosahuje jen 9 %, v Karibiku až 33,5 % (Graf 1) (11). Naše hodnota 19,77 % se blíží průměrné hodnotě v rozvinutých zemích.
V české retrospektivní studii z roku 2011 (která však hodnotí výskyt GBS v rámci neonatálních infekcí) vychází rezistence GBS na erytromycin 39 % a klindamycin 40 % (12). Jedná se však o malý soubor dat (řádově jednotky případů). Z našich dat vyplývají nižší hodnoty: erytromycin 20,45 %, klindamycin 15,52 %. Nicméně je nutné brát v potaz, že jsme neprováděli serotypizaci kmenů GBS, čímž by se odlišily neinvazivní kmeny od invazivních, které způsobují peripartální a perinatální infekce. To může vysvětlovat rozdíly mezi rezistencemi.
Průměrná prevalence v Libereckém kraji vyšla 19,77 % (3 579/18 108; 95% CI 18,1 - 21,4). Rezistence na ampicilin (penicilin) odpovídá 0,65 % (5/700; 95% CI -0,18 - 1,48), na klindamycin 15,52 % (111/700; 95% CI 11,6 – 19,44), na erytromycin 20,45 % (144/700; 95% CI 16,06 – 24,84) a na vankomycin 0 %. Vzhledem k relativně vysoké četnosti rezistencí je vhodné u GBS kultivací provádět vyšetření na antibiotickou citlivost. Cílená peripartální antibiotická profylaxe totiž s velkou účinností zabraňuje potenciálně velmi nebezpečné časné neonatální infekci.