









 Rada pro výzkum, vývoj a inovace: Seznam recenzovaných neimpaktovaných časopisů vydávaných v ČR
Oficielní časopis České společnosti pro ultrazvuk v porodnictví a gynekologii.
Rada pro výzkum, vývoj a inovace: Seznam recenzovaných neimpaktovaných časopisů vydávaných v ČR
Oficielní časopis České společnosti pro ultrazvuk v porodnictví a gynekologii.

Práce shrnuje dosavadní poznatky doložené evidencí o onemocnění COVID-19 ve vztahu k ženám v reprodukčním věku a zejména k těhotným samotným. V těhotenství SARS-CoV-2 potencionálně ohrožuje nejen matku, ale i dosud nenarozený plod. Provádíme kritickou analýzu informací o vertikálním a horizontálním přenosu, zabýváme se managementem péče a léčbou těhotné ženy a nedělky. Samostatně referujeme o současných poznatcích o očkování v souvislosti s těhotenstvím, šestinedělím a kojením. Jsme si vědomi, že tento souhrn je platný v době publikace a je možné, že rychlým přísunem nových informací mohou některá tvrzení ztratit na významu.
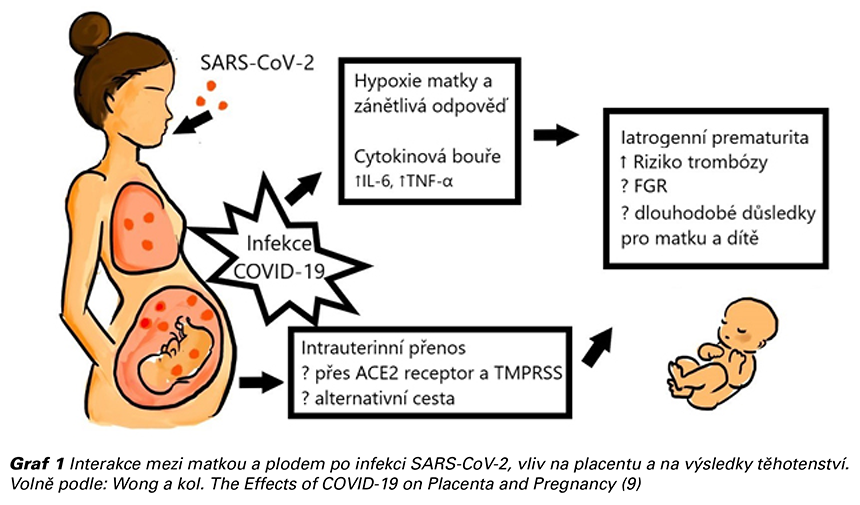
Pandemie COVID-19 ohrožuje sice především vyšší věkové kategorie, ale může ohrožovat i ženy v reprodukčním věku a dosud nenarozené plody a novorozence. Informací o těhotných ženách nakažených COVID-19 je stále ještě málo, a navíc nejsou jednotné (1). Těhotné mají vyšší riziko získání nákazy v důsledku zaměstnání (pečovatelky, zdravotnice, učitelky), nebo mohou mít vyšší riziko závažnějšího průběhu v důsledku stávajícího zdravotního stavu: hypertenze, srdečního onemocnění, astmatu, pregestačního diabetu, vyšší váhy, věku nad 35 let, ale také jen díky vyššímu stádiu těhotenství (nad 28 týdnů) (2). Těhotenské změny predisponují ženy k závažnějšímu průběhu virových respiračních onemocnění (3,4). Je známo, že během těhotenství dochází, spolu s hormonálními vlivy, ke změně imunitní odpovědi. Jedná se o mechanizmy, které se podílí na toleranci plodu a ochraně před imunitní odpovědí matky. V těhotenství dochází ke změnám v počtech imunitních buněk. Je snížený počet, aktivita a proliferace T-lymfocytů a NK buněk. Koncentrace sérových imunoglobulinů v těhotenství vzrůstají (jsou změny podtříd imunoglobulinů). Zároveň dochází ke změnám kardiopulmonálního systému - zvýšení tepové frekvence a srdečního výdeje a snížení funkční reziduální kapacity na podkladě anatomických změn bránice a hrudníku. To vše může vést ke snížené respirační kapacitě a hypoxii během akutního plicního onemocnění (4).
Klinické příznaky jsou u těhotných žen srovnatelné s běžnou populací (2,4,5). Symptomy jsou většinou mírné a 15 % nakažených je asymptomatických (1). Mezi nejčastější patří horečka (53-66,8 %) a suchý kašel (34 %). Méně často se pak vyskytuje dušnost (18 %) nebo průjem (3 %). Výskyt těžkého průběhu onemocnění se odhaduje na 7 % a mateřská mortalita na 1,6 % (1,2,6,7,8,9,10,11). Závažnější průběh se obvykle vyskytuje u těhotných žen s chronickými onemocněními jako je obezita, astma, hypertenze a pregestační diabetes (2,7,12). Rizikovým faktorem pro závažnější průběh je také vyšší věk matky (12).
U pacientů s těžkým průběhem onemocnění COVID-19 byly zaznamenány hemostatické změny a zvýšený výskyt trombotických komplikací. Těhotenství je protrombotický stav, a proto u COVID-pozitivních těhotných žen existuje zvýšené riziko tromboembolických komplikací (13).
Nejsou žádné údaje o zvýšeném riziku vrozených vad v důsledku styku s tímto virem. Je nicméně nutno říci, že virová onemocnění obecně a horečky v prvním trimestru rizika těchto komplikací zvyšují, je tedy na místě chránit se stejně, jako před jiným virovým, např. chřipkovým onemocněním. Zkušenosti s viry MERS a SARS neprokázaly souvislost s vyšším rizikem prvo- a druhotrimestrálního potratu. U COVID-19 pozitivních žen byl zaznamenán vyšší výskyt předčasného porodu a nízké porodní hmotnosti plodu (4,14). Příčinná souvislost však nebyla zatím jednoznačně prokázána. V 99,3 % těhotenství končí porodem živého dítěte. Potrat před 20. tt se vyskytuje u 0,3 % COVID- 19 pozitivních žen a po 20. tt u 0,4 %. Většina dat se však týká těhotných žen, které COVID-19 prodělaly ve třetím trimestru, a proto zatím nejsou známy účinky na plod v časném těhotenství a dlouhodobé důsledky pro dítě (14). Ženy s diagnózou COVID-19 mají vyšší riziko závažných porodnických komplikací jako je preeklampsie, eklampsie a HELLP syndrom (11).
Od začátku pandemie COVID-19 se objevily případy COVID-19 suspektních nebo pozitivních žen, které rodily císařským řezem bez jasné porodnické indikace s cílem snížit riziko intrapartálního přenosu infekce (5). Počet císařských řezů a předčasných porodů je u této skupiny žen vyšší, což může být důsledek rozhodnutí porodníků o dřívějším ukončení těhotenství kvůli závažnému průběhu infekce u matky (bilaterální pneumonie s respirační insuficiencí a šokem) (2,4). Indikace k císařskému řezu by měla být vždy pečlivě zvažována s jasným benefitem pro matku či plod. Dále je potřeba vzít v úvahu, že ve srovnání se spontánním porodem dochází při císařském řezu, ale i při dalším pobytu na jednotce intenzivní péče a na oddělení šestinedělí k expozici většího množství zdravotnického personálu. Spontánní vaginální porod by měl mít přednost před císařským řezem, který by měl zůstat vyhrazen pouze pro porodnické indikace ze strany matky a plodu (1,15).
Hlavní cestou přenosu infekce COVID-19 jsou kapénky, přímý kontakt a přenos aerosoly. Novorozenec se tedy nejpravděpodobněji nakazí při styku s pečovateli (primárně s matkou). Proto se u matek bez příznaků nebo jen s mírnými příznaky doporučuje dodržování základních hygienických pravidel, jako je nošení roušky při kojení či kontaktu s dítětem a mytí rukou (16,17). Postýlka novorozence by měla být alespoň dva metry od postele matky (1). Separace novorozence od matky může způsobit stres a případnou zástavu laktace, a proto se nedoporučuje. Pokud uběhlo již 10 dní od prvních příznaků nebo 20 dní od kritického klinického stavu, riziko nákazy novorozence je prakticky nulové. Riziko je také nízké, pokud uplynulo 24 hodin od poslední horečky (bez medikace) a došlo ke zlepšení příznaků (16).
SARS-CoV-2 infikuje cílové buňky vazbou na membránový angiotenzin konvertující enzym II (ACE2), což je usnadněno transmembránovou proteázou serinem II (TMPRSS2). Hojná koexprese virového receptoru ACE2 a TMPRSS2 v lidské placentě teoreticky zvyšuje vnímavost placenty a případně i plodu k infekci SARS-CoV-2 (9). Exprese ACE2 a TMPRSS2 v placentě negativně koreluje s gestačním stářím. Teoreticky je tak v prvním trimestru větší šance na transplacentární přenos než v pozdějších fázích těhotenství (18). Překvapivě však SARS-CoV-2 nebyl detekován v materiálu z potratu/placentě u prvotrimestrálních a druhotrimestrálních abortů, ačkoliv těhotné ženy byly COVID-19 pozitivní. Na druhou stranu byl virus detekován v amniální tekutině u předčasně narozených dětí pozitivních žen ve třetím trimestru. V placentách těhotných žen nakažených SARS-CoV-2 byly prokázány známky maternální vaskulární malperfúze (MVM), která je spojována s klinickými následky jako například předčasný porod, fetální růstová restrikce a úmrtí plodu. Sekundární hypoxie matky při plicní infekci COVID-19 může způsobit uterinní hypoperfúzi a následné hypoxicko-ischemické poškození placenty (9).
Studie devíti žen pozitivních na COVID-19, kde byly testovány vzorky amniální tekutiny, pupečníková krev a výtěry z krku novorozence, nepotvrdila intrauterinní přenos infekce COVID-19 v pozdním těhotenství. Studie je však limitována malou skupinou testovaných (5). Nicméně existují novější případy, kdy u novorozenců COVID-19 pozitivních matek byly detekovány IgM protilátky bez přítomnosti virové RNA, což by mohlo ukazovat na možnost vertikálního přenosu (15,19,20,21). Perinatální infekce u novorozenců však není častá (2,6-3,2 %) (14,22).
Většina dostupných studií nepotvrzuje, že by se infekce COVID-19 přenášela kojením (5,16). Jsou známy případy, kdy byla izolována RNA viru z mateřského mléka COVID-19 pozitivních žen, ale jeho role v přenosu infekce na novorozence není jasná (23,24). Výhody kojení výrazně převyšují rizika vertikálního přenosu, protože mateřské mléko obsahuje IgA a IgG protilátky proti SARS-CoV-2 (17,23,25). Pasivní imunita získaná od matky, která COVID-19 prodělala, tak může mít protektivní vliv před onemocněním novorozence (15,26).
Všechny těhotné ženy navštěvující nemocnici by měly mít zakrytá ústa a nos. Při kontaktu s pacientkou vyšetřovanou na infekci COVID-19 by měl personál nosit osobní ochranné pracovní prostředky (OOPP). To zahrnuje ochranu před kapénkami (chirurgická rouška nebo respirátor s brýlemi/ochranný štít, plášť a rukavice). Nasofaryngeální a orofaryngeální výtěr by měl být proveden u všech pacientek s chřipkovými příznaky a plošné testování bezpříznakových pacientek závisí na aktuální epidemiologické situaci (27). U pacientek v závažném stavu lze použít sputum a/nebo endotracheální aspirát, případně bronchoalveolární laváž (16). Testování doprovodu záleží na daném zdravotnickém zařízení. Počet zdravotnických pracovníků by měl být omezen na minimum s dalšími k dispozici v případě komplikací (2,15,28,29).
U COVID-19 pozitivních žen dle doporučení ECOG a FIGO plánujeme kontrolu na konec karantény. Dle doporučení ISUOG lze kontrolu odsunout o 14 dní, nebo do dvou negativních výsledků testu (30). Pokud vyšetření odložit nelze (např. prvotrimestrální screening), mělo by být provedeno za dodržení epidemiologických opatření. Žena by měla být poučena o důležitosti sledování vnímání pohybů plodu (29). U COVID-19 pozitivních žen existuje riziko FGR, a proto se doporučuje ultrazvukové vyšetření á 4-6 týdnů (váhový přírůstek plodu, množství plodové vody, průtoky v a. umbilicalis) (3).
U pacientek s mírnými příznaky ve stabilizovaném stavu je preferován spontánní vaginální porod v termínu. V kritických případech však mohou výhody ukončení těhotenství (indukovaný porod nebo porod císařským řezem) převažovat nad riziky (16). U pacientek s respiračními obtížemi by druhá doba porodní měla trvat co nejkratší dobu (29). Preferujeme epidurální analgezii a jiné metody tlumení bolesti před inhalační analgezií z důvodu vzniku kapének (30).
Při lehkém průběhu je léčba symptomatická antipyretiky (lze zvážit i preventivní podávání kyseliny acetylosalicylové pro antiagregační účinek jako prevence tromboembolizmu), antitusika/expektorancia dle potřeby. Dušnost či pO2 < 94 je indikací k hospitalizaci (29).
K léčbě antibiotiky přistupujeme při podezření na sekundární bakteriální pneumonii se zvýšením počtu leukocytů v krevním obraze, zvýšeném CRP či prokalcitoninu (29). Mezi COVID-19 specifickou léčbu pacientů s rizikem závažného průběhu patří virostatikum remdesivir, který u hospitalizovaných pacientů mírně zkracuje délku onemocnění (31), o bezpečnosti jeho užití v graviditě však není dostatek informací (32).
U pacientů s vysokým rizikem závažného průběhu lze aplikovat monoklonální protilátky bamlavinimab nebo kombinaci casirivimab + imdevimab, o případném užití těchto léků v graviditě však chybějí informace (33).
Saturace by měla být udržována > 94 %. U pacientů na oxygenoterapii je vhodné využít protizánětlivý efekt dexametazonu. U některých pacientek s ARDS nebo SARI může být nutná intubace, nebo ECMO společně s polohováním. Doplnění tekutin by mělo začínat 250-500ml bolusem krystaloidu. Samozřejmostí je klidový režim, dostatečná výživa a kontrola elektrolytové rovnováhy (29).
Těhotenství také zvyšuje riziko trombózy, a proto někteří autoři doporučují u pacientek s COVID-19 antikoagulační profylaxi. Při rozhodnutí o zahájení a trvání LMWH profylaxe by mělo být zváženo následující: závažnost onemocnění, hospitalizace/domácí léčba, termín porodu, komorbidity. Tromboprofylaxe by poté měla pokračovat po dobu deseti dní až celé šestinedělí v závislosti na závažnosti onemocnění, obzvláště u žen se zvýšeným rizikem HŽT. Zcela zásadní je pak poučení těhotné ženy o nutnosti mobilizace a dostatečné hydratace (13).
Stejně jako u jiných léků a vakcín, nejsou dosud těhotné ženy součástí klinických studií. Obecně jsou téměř všechny druhy vakcín v těhotenství povolené, kromě živých atenuovaných vakcín, kde je teoretické riziko, že virus projde placentou a nakazí plod. První dvě autorizované vakcíny proti COVID-19 používají technologie mRNA, která kóduje protein na povrchu viru, který je pak rozpoznán imunitním systémem (34). Tyto mRNA vakcíny neobsahují živý virus, a proto CDC (Centers for Disease Control and Prevention), ACOG (American College of Obstetricians and Gynecologists) a SMFM (Society for Maternal-Fetal Medicine) očkování ženám, které splňují kritéria (např. zdravotnické pracovnice), doporučují (35,36). U naočkovaných těhotných a kojících žen došlo ke stejné humorální imunitní odpovědi jako u netěhotných. Zároveň očkované ženy měly vyšší titr protilátek, než ženy po prodělané infekci COVID-19 v těhotenství. Protilátky vytvořené díky vakcíně byly nalezeny v pupečníkové krvi a mateřském mléce, což by mohlo hrát zásadní roli v mRNA vakcínou indukované imunitě novorozence. Placentou prochází pouze IgG. Jak víme ze studií vakcín proti jiným virovým patogenům (jako VHA, VHB, RSV), role IgG protilátek v mateřském mléce je pro imunitu novorozence zásadní (37). Během kojení je velice nepravděpodobné, že by vakcína jako taková měla biologické účinky na dítě (34). Pokud by se intaktní nanočástice nebo mRNA dostala přes krevní oběh do mateřského mléka, s největší pravděpodobností ji dítě degraduje. Známé vedlejší účinky očkování, jako je zvýšená teplota, zimnice nebo bolesti svalů, mohou u těhotných vyvolat obavy. Důležité je, aby byly o vedlejších účincích poučeny a tím se zamezilo zbytečným akutním návštěvám pohotovosti (38).
Publikace byla podpořena výzkumným záměrem RVO-VFN64165.