








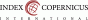

 Rada pro výzkum, vývoj a inovace: Seznam recenzovaných neimpaktovaných časopisů vydávaných v ČR
Oficielní časopis České společnosti pro ultrazvuk v porodnictví a gynekologii.
Rada pro výzkum, vývoj a inovace: Seznam recenzovaných neimpaktovaných časopisů vydávaných v ČR
Oficielní časopis České společnosti pro ultrazvuk v porodnictví a gynekologii.

Management pacientek s nízkou odpovědí na kontrolovanou ovariální hyperstimulaci (KOH) je obtížnou a pořád kontroverzní otázkou. Přestože během posledních několika dekád došlo k výrazným pokrokům v reprodukční medicíně, dosud chybí konsenzus týkající se léčby neplodnosti v této populační skupině. Nově objevující se důkazy jasně hovoří o tom, že pro navýšení úspěšnosti léčení sterility je z hlediska kumulativní úspěšnosti IVF cyklu důležitý počet získaných oocytů, který se dá optimalizovat správným odhadem ovariální rezervy s přihlédnutím k věku pacientky. Léta existující paradigma folikulogeneze (jeden cyklus = jedná kohorta folikulů odpovídajících na stimulaci) byla překonána teorií folikulárních vln, což otevřelo nové terapeutické možnosti u starších pacientek s malou ovariální rezervou. V tomto souhrnném článku jsou uvedené aktuální informace týkající se problematiky pacientek s nízkou reakcí na KOH, včetně přesnější klasifikace těchto pacientek dle expertní skupiny POSEIDON a současné poznatky o Duostim protokolu – slibným nástrojem pro zlepšení výsledků terapie sterility u žen s nedostatečnou odezvou ovarií na KOH.
Narůstající trend odsouvání mateřství na pokročilejší věk a pokroky v léčbě onkologicky nemocných pacientek přináší nové výzvy oboru reprodukční medicína. V prvním případě je to nárůstem počtů pacientek se sníženou ovariální rezervou, v druhém případě jde o snahu zlepšení kvality života pacientek přeživším onkologickou léčbu umožněním mít potomky z vlastních gamet. Navíc, v obou skupinách se setkáváme s pacientkami nedostatečně reagujícími na KOH (poor responders). Prevalence poor responders je těžko hodnotitelná, odhaduje se prevalence mezi 9 a 24 % (1). Nehledě na vědecké a technologické pokroky, léčba těchto pacientek zůstává velmi diskutovanou otázkou. Dalším faktem je, že populace těchto pacientek není homogenní a jejich prognóza může hodně kolísat dle věku a počtu získaných oocytů v rámci léčby (2). V posledních létech se objevují nové práce, které se zabývají otázkou navýšení úspěšnosti léčení pacientek s nízkou ovariální odpovědí s využitím relativně nového přístupu KOH – Duostim protokolu, zahrnujícím dvě stimulace a dva odběry oocytů v rámci jednoho ovariálního cyklu (jednou ve folikulární fázi a jednou v luteální fázi).
Folikulogeneze je extrémně dynamickým a komplexním fyziologickým dějem. Klasická teorie folikulogeneze u homo sapiens (teorie jednorázové selekce) mluví o jedné kohortě antrálních folikulů rostoucích během folikulární fáze ovariálního cyklu, ze které se následně vyselektuje dominantní (Graafův) folikul. Tato teorie je během poslední dekády doplněna o další dvě teorie: teorie kontinuální selekce a teorie vlnové selekce. Důkazy, vedoucí ke vzniku těchto dvou teorií, byly nejdříve nalezeny u velkých savců (3-8), následně potvrzeny i u homo sapiens (9,10). Podle teorie vlnové selekce během jednoho ovariálního cyklu dochází postupně k selekci 2 – 3 kohort antrálních folikulů, zatímco dle teorie kontinuální selekce dochází k růstu a atrezii folikulů kontinuálně během celého ovariálního cyklu. Teorie vlnové selekce antrálních folikulů rozlišuje velké a malé vlny, přičemž jen ty velké jsou ovulační (11,12).
Dynamika antrálních folikulů se zdá být druhově specifická a pozitivně koreluje s délkou menstruačního cyklu, tj. při kratších interovulačních intervalech jsou obvykle detekovatelné dvě selekční vlny, zatímco při delších interovulačních intervalech můžeme identifikovat tři selekční vlny (10,11).
Přestože bylo identifikováno několik regulátorů (včetně FSH, progesteronu a některých zánětlivých cytokinů) hrajících důležité úlohy v homeostáze folikulárních vln, přesný mechanizmus vedoucí k folikulární selekci v jednotlivých vlnách nebyl zatím objasněn. Hladina FSH blokuje atrezii antrálních folikulů vznikajících v dalších vlnách (13), vysoká hladina progesteronu produkovaného žlutým tělískem v luteální fázi hraje důležitou úlohu v regulaci vzniku velkých a malých folikulárních vln (inhibicí hypofýzy mechanizmem negativní zpětné vazby – tím pádem během malých folikulárních vln nedochází k finální maturaci folikulu) (14). Nicméně byl prokázán růst folikulů při podání gonadotropinů v luteální fázi cyklu (15-17). Z klinické perspektivy, tyto nové poznatky týkající se folikulární selekce ve vlnách otevírají nové možnosti z hlediska zvýšení efektivity IVF a postupně k vývoji dvou nových strategií KOH – random start protokolu a Duostim protokolu (18). Z důvodu prostorového omezení tohoto sdělení níže budou uvedena existující data týkající se duostim protokolů.
Cílem IVF cyklu je porod zdravého dítěte. Z tohoto hlediska pokroky v kryoprezervaci embryí vedly k radikálním změnám, aktuálním měřítkem úspěšnosti IVF cyklu je de facto kumulativní míra živorodnosti (cumulative live birth rate - CLBR) na jeden IVF cyklus, tj. na jednu zahájenou KOH (19). Ovariální rezerva a věk ženy jsou momentálně nejdůležitějšími prediktory CLBR. Bylo navrženo několik prediktorů ovariální rezervy (kromě věku ženy) – AMH, FSH a počet antrálních folikulů (antral follicular count – AFC). Věk ženy je nejlepším prediktorem kompetence oocytů, než indikátorem reakce ovarií na KOH, i přestože věk ženy a ovariální rezerva jsou na sobě silně závislé, věk ženy je silnějším prediktorem klinického výsledku, hlavně z hlediska genetické a reprodukční kompetence oocytů. Proto plánování léčby každé pacientky má brát ohled na její věk a správné posouzení její ovariální rezervy.
Několik studií se zabývalo počtem získaných oocytů potřebných pro zvýšení úspěšnosti v IVF cyklech s transferem čerstvých embryí (20-23) – napříč těmito studiemi průměrný optimální počet oocytů byl 10 –15. Dle Boloňských kritérií, nízká ovariální reakce na KOH (poor responder) je definována ziskem 3 či méně oocytů během jednoho cyklu KOH (24). Nicméně, při dobře fungujícím kryoprezervačním programu, čím vyšší počet oocytů získáme, tím větší CLBR budeme mít na jeden započatý IVF cyklus, sečteme-li transfery čerstvých embryí s transfery kryoprezervovaných embryí (25-27). Tím pádem se krystalizuje nová skupina pacientek se ziskem 4 – 9 oocytů/cyklus, která je definována jako skupina se „suboptimální“ reakcí na KOH (Tab. 1).
Přesnější klasifikace pacientek s malou ovariální rezervou nebo s neobvyklou reakcí na KOH posunuje koncept nízké odpovědi ke konceptu špatné prognózy a (jak se uvidí z níže uvedeného textu) zahrnuje nejen počet získaných oocytů, ale i míru aneuploidie a ovariální senzitivity vůči exogenním gonadotropinům.
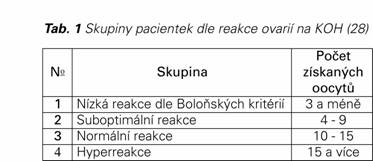
Počet oocytů není jediným faktorem ovlivňujícím CLBR, dalším silným prediktorem z hlediska úspěšnosti IVF cyklu je podíl chromozomálně aneuploidních embryí, který je spojen s věkem ženy. Procento aneuploidních embryí je závislé na věku a pohybuje se od 25 do 30 % u žen mladších 35 let až do 90 % u žen starších 42 let (29,30). Nicméně, trasferujeme-li euploidní blastocystu, její míra implantace není závislá na věku ženy (31), a pravděpodobně ani na její morfologické kvalitě (32). Odhady počtů MII oocytů potřebných pro zisk aspoň jedné euploidní blastocysty jsou uvedené v Tab. 2 (data nezahrnují případy, na kterých se podílí i andrologický faktor sterility).
Proto nelze predikovat úspěšnost léčby jen na základě počtu získaných oocytů, reálně pacientky se stejným počtem získaných oocytů mohou mít diametrálně odlišné úspěšnosti z důvodu odlišných mír aneuploidií.
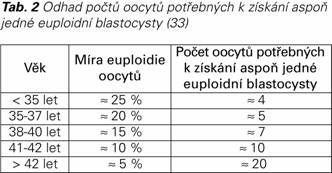
Revize Boloňských kritérií provedená expertní pracovní skupinou POSEIDON (Patient-Oriented Strategies Encompassing IndividualizeD Oocyte Number) má za cíl zlepšení diagnostického procesu a managementu pacientek s POR. Výsledkem by měla být optimalizace počtů získaných oocytů potřebných pro vznik aspoň jednoho euploidního embrya u pacientek s různou ovariální odpovědí na gonadotropiny (34). Pro lepší volbu léčebné strategie byly touto pracovní skupinou definované čtyři skupiny pacientek s POR (Tab. 3).
Během posledních 30 let bylo navrženo několik strategií pro zlepšení výsledků léčby u pacientek s POR, nicméně dosud nedošlo k žádnému konsenzu v této oblasti (1,35-39). Nejčastěji používanou strategií je navýšení dávek gonadotropinů, která ale nevede k signifikantnímu navýšení počtu odebraných oocytů (40,41), protože gonadotropiny podporují růst folikulů citlivých na stimulaci a nevedou ke vzniku folikulů de novo (40,42,43).
Normogonadotropní pacientky s dostatečnou ovariální rezervou, ale s neočekávanou nízkou nebo suboptimální odpovědí na KOH (skupina POSEIDON 1 a 2, viz Tab. 3), tvoří zhruba 15 % IVF populace a k zisku adekvátního počtu oocytů (> 3) potřebují vyšší dávky gonadotropinů (> 3 000 IU) a delší dobu stimulace (> 10 dní) (44). Jedná se o sníženou odpověď ovarií na FSH, což může být vysvětleno hyposenzitivitou granulózových buněk vůči standardním dávkám gonadotropinů danou buď polymorfizmy FSH receptoru (45) a/nebo méně bioaktivními izoformami LH (46). V této skupině pacientek včasným odhalením snížené odpovědi (do 5. – 8. dne KOH), zvýšením dávek FSH a přidáním LH můžeme dosáhnout většího zisku oocytů, protože LH aktivita může vylepšit hladiny endogenních androgenů (47) a navýšit počet FSH receptorů v granulózových buňkách (48,49), což pravděpodobně vede k zesílení ovariální odpovědi na FSH (48,50). Dalšími příčinami snížené odpovědi mohou být nedostatečné (podprahové) dávky FSH nebo asynchronní růst folikulů. V případě asynchronního růstu můžeme využít perorální estrogeny, kombinovanou orální kontracepci nebo gestageny k synchronizaci folikulů v rámci folikulární vlny, nebo alternativně downregulaci v rámci dlouhého agonistického protokolu (51-57).
Normogonadotropní nebo hypergonadotropní pacientky s malou ovariální rezervou (skupina POSEIDON 3 a 4, viz Tab. 3) nemohou profitovat jen z navýšení dávek gonadotropinů vzhledem k tomu, že vysoké dávky FSH nemohou kompenzovat absenci folikulů. U těchto pacientek se doporučuje stimulace antagonistickými protokoly s dávkami FSH do 300 - 375 IU denně v kombinaci s LH, což u starších žen (skupina POSEIDON 4) může vést k vyššímu počtu rostoucích folikulů v synergii s IGF1 (insulin-like growth factor 1) (58-62). Pokud ovšem u těchto pacientek chceme získat větší počet oocytů za účelem dosažení většího CLBR, musíme provést dvě KOH v rámci jednoho ovariálního cyklu s využitím i malých folikulárních vln – Duostim protokol (33).
První zkušenosti s dvojí stimulací ukázaly, že KOH ve folikulární a v luteální fázi stejného ovariálního cyklu vede k zisku oocytů se stejným vývojovým potenciálem (14). Ke stimulaci v tomto protokolu (Shanghai protokol) byl použit klomifen citrát 25 mg/den, letrozol 2,5 mg/den a 150 - 225 IU/den humánního menopauzálního gonadotropinu, v rámci studie zahrnující 38 pacientek s nízkou ovariální odpovědí dle Boloňských kritérií. V obou fázích stimulace byla indukce maturace oocytů provedena GnRH agonistou (triptorelin), po které následovalo podání ibuprofenu 0,6 mg v den indukce maturace a následující den z důvodu prevence předčasné ovulace. V případě potřeby delší stimulace v luteální fázi bylo podáno 10 mg medroxyprogesteron acetátu denně od 12. dne luteální KOH k oddálení menzes a k zamezení odběru oocytů za menstruačního krvácení pro prevenci infekčních komplikací (viz Obr. 1).
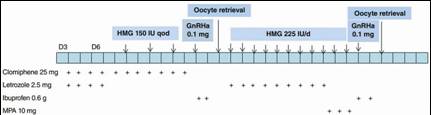
Obr. 1 Shanghai protokol (14)
GnRHa – agonista gonadotropin uvolňujícího hormonu, HMG – humánní menopauzální gonadotropin, MPA – medroxyprogesteron acetát, qod – ob den
V roce 2016 byla publikována další studie zabývající se Duostim protokolem u 51 pacientek se špatnou prognózou, ve které se získaná embrya testovala pomocí preimplantačního genetického screeningu aneuploidií (PGT-A) (63). Výsledky této studie ukázaly, že použití Duostim protokolu v populaci pacientek se špatnou prognózou zvyšuje pravděpodobnost zisku aspoň jedné euploidní blastocysty ze 42 na téměř 70 %. V této studii byl ke stimulaci použit konvenční antagonistický protokol v obou fázích cyklu, podobně jako v jedné další studii (64): FSH 300 IU/den spolu s LH 75 IU/den, GnRH antagonista k prevenci předčasné ovulace a indukce maturace oocytů GnRH agonistou (buserelin) (viz Obr. 2). Podrobná komparativní analýza stimulace ve folikulární a luteální fázi cyklu nenašla signifikantní rozdíly mezi délkami stimulace, počty získaných MII oocytů, počty oplozených oocytů, počty blastocyst a mírami euploidie (počet euploidních blastocyst vztažený na počet oplozených oocytů). Navíc nebyly nalezeny signifikantní kvalitativní odlišnosti blastocyst pocházejících z obou fází KOH.
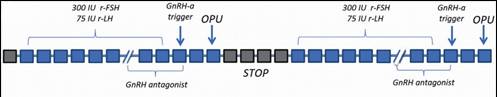
Obr. 2 Duostim protokol (63)
r-FSH – rekombinantní folikulostimulační hormon, r-LH – rekombinantní luteinizační hormon, OPU – odběr oocytů, GnRHa – agonista gonadotropin uvolňujícího hormonu
Aktuálně se dokončuje prospektivní multicentrická studie 3 400 MII oocytů (1 700 z folikulární fáze a 1 700 z luteální fáze), jejímž cílem je poukázat na jejich stejný vývojový potenciál (33). Předběžná analýza výsledků 1 723 MII oocytů (763 z folikulární fáze a 960 z luteální fáze) ukazuje na podobný vývojový potenciál (z hlediska fertilizace, blastulace a míry euploidie) oocytů pocházejících z KOH ve folikulární a luteální fázi. Předběžné výsledky navíc poukazují na trend získávání vyššího počtu oocytů v luteální fázi cyklu (65). Z hlediska bezpečnosti nedošlo k navýšení počtu komplikací po odběrech oocytů.
Z existujících dat vyplývá, že KOH může být odpojena od fáze ovariálního cyklu, protože vysoké hladiny progesteronu neovlivňují maturaci folikulů, odběr oocytů a jejich vývojový potenciál (14,63). Rovněž není vyšší výskyt vrozených vývojových vad v těhotenstvích z oocytů po KOH v luteální fázi cyklu (66). Duostim protokol může snížit negativní emoční impakt léčby u pacientek bez zisku embryí po KOH ve folikulární fázi tím, že se mohou získat kvalitní embrya po KOH v luteální fázi stejného cyklu (67).
Pacientky s indikací Duostim protokolu v rámci IVF cyklu by měly splňovat aspoň dva z následujících parametrů (68):
Jako jediný parametr by měl stačit malý počet získaných oocytů (≤ 3) v předchozích dvou a více IVF cyklech nebo indikace z hlediska onkofertility. Z pochopitelných důvodů Duostim protokol nedovoluje embryotransfer čerstvých embryí, kryoembryotransfer embrya může proběhnout v následných ovariálních cyklech za synchronizace embrya a endometria.
Léčba pacientek nedostatečně reagujících na KOH by měla zohledňovat jejich věk a správné vyhodnocení ovariální rezervy s cílem vyššího CLBR na každý započatý cyklus. V tomto procesu je důležitý výběr správné léčebné strategie, následkem které bude zisk optimálního počtu oocytů, zvyšující (s ohledem na věk pacientky) pravděpodobnost zisku aspoň jedné euploidní blastocysty. Vyšší dávky gonadotropinů nevedou k vyššímu počtu získaných oocytů, gonadotropiny jen podporují růst kohort folikulů citlivých na stimulaci a nemohou vést k jejich de novo tvorbě. Existence několika folikulárních vln dovolilo vznik ovariálních stimulačních protokolů se startem v luteální fázi cyklu. Duostim protokol (kombinace stimulace ve folikulární a luteální fázi cyklu) se jeví slibným přístupem z hlediska zvýšení počtu oocytů získaných během jednoho ovariálního cyklu, nicméně je nutná studie nákladové efektivity tohoto postupu.