









 Rada pro výzkum, vývoj a inovace: Seznam recenzovaných neimpaktovaných časopisů vydávaných v ČR
Oficielní časopis České společnosti pro ultrazvuk v porodnictví a gynekologii.
Rada pro výzkum, vývoj a inovace: Seznam recenzovaných neimpaktovaných časopisů vydávaných v ČR
Oficielní časopis České společnosti pro ultrazvuk v porodnictví a gynekologii.

Radioterapie je jednou z léčebných modalit v terapii gynekologických malignit. Je využívána jak zevní (ERT – externí radioterapie), tak vnitřní radioterapie (BRT – brachyradioterapie). Pomocí moderních plánovacích systémů dochází k minimalizaci iradiace okolních tkání a redukci akutních a pozdních poradiačních nežádoucích účinků. I přes využití těchto moderních technologií dochází k iradiaci okolních tkání a výskytu nežádoucích účinků. Nejčastěji dochází k iradiaci kůže, gastrointestinálního traktu, urogenitálního a hematopoetického systému. Podle doby nástupu a mechanizmu vzniku dělíme reakce na akutní (časné) a pozdní, podle rozsahu na lokální a systémové. Akutní a chronické změny hodnotíme pomocí vytvořených skórovacích systémů. K objektivnímu hodnocení celkového stavu pacientky slouží Karnofského index nebo WHO klasifikace. Vzhledem k nežádoucím účinkům je zcela zásadní, aby byla radioterapie indikována a individuálně diskutována v rámci mezioborové indikační komise pro gynekologické malignity - „tumor boardu“.
Radioterapie je léčebnou modalitou, která využívá ionizujícího záření k léčbě nádorových a nenádorových onemocnění. Tvoří významnou součást léčebného postupu u onkologických pacientek, o její nezastupitelné roli v léčbě gynekologických malignit není pochyb. V léčbě gynekologických malignit je využívána jak zevní (ERT – externí radioterapie), tak vnitřní radioterapie (BRT - brachyradioterapie). Frakcionací vysokých dávek záření a případnou kombinací zevní radioterapie a brachyterapie lze dosáhnou vyššího terapeutického efektu, čehož se v onkogynekologii často využívá (1,2). Při zevní radioterapii, kdy je zdroj záření mimo tělo pacientky, dnes používané lineární akcelerátory koncentrují v krátkém čase vysoké dávky ionizujícího záření do míst nádoru. Pomocí moderních plánovacích systémů sdružujících data ze zobrazovacích vyšetření (CT, MRI, ultrazvuk) dochází k minimální iradiaci okolních tkání, čímž je zajištěna vysoká bezpečnost těchto metod a redukce akutních a pozdních poradiačních nežádoucích účinků. Mezi takové systémy patří 3DCRT (Three-Dimensional Conformal Radiotherapy) (3), SBRT (Stereotactic Body Radiotherapy) a CyberKnife (4,5), IMRT (Intensity–Modulated Radiation Therapy) (3) a IGRT (Image Guided Radiotherapy) (6). Brachyterapie je vysoce efektivní léčebná modalita, při které je ionizující záření cíleno na nádorovou masu v blízkosti zářiče. Brachyterapie zažívá v posledních letech renezanci po zavedení after-loadingu. Díky tomu se dnes dominantně využívají vysokodávkové systémy (High dose rate - HDR), při kterých jsou aplikátory záření zavedeny intrakavitárně nebo intersticiálně. Navíc pomocí moderních 3D simulací dochází ještě k přesnějšímu zacílení záření a minimalizaci ozáření okolní zdravé tkáně (1,2). I při využití výše zmíněných moderních technologií radioterapie a vysoké přesnosti metody dochází k iradiaci okolních tkání. To vede k relativně častým akutním a pozdním nežádoucím účinkům. Toxicita radioterapie u gynekologických malignit je dle recentních dat uváděna mezi 5 – 15 %, nicméně frekvence nežádoucích účinků udávaných pacientkami je daleko vyšší. Nejčastěji dochází k iradiaci kůže, gastrointestinálního traktu, urogenitálního a hematopoetického systému (7). Cílem této práce je pojednat o nejčastějších nežádoucích účincích radioterapie u pacientek léčených pro gynekologické malignity. O managementu komplikací radioterapie se v práci zmíníme jen okrajově, neboť není předmětem přehledové práce.
Při ozáření živého organizmu dochází v průběhu času ke změnám fyzikálním, chemickým a biologickým. Ionizující záření při průniku buňkou poškozuje její membrány, enzymatický systém, klíčově pak DNA. Dle intenzity záření buňka reaguje buď zastavením svého růstu (growth arest) a poškození opraví anebo dojde k apoptóze. Míra schopnosti reparace a apoptózy je jeden z rozdílu mezi nádorovými a zdravými buňkami. Nádory se liší citlivostí na radioterapii. Rychle proliferující nádory regredují po ionizaci rychle, zatímco pomalu se dělící nádory mohou regredovat i měsíce. Reakce buňky na ozáření závisí i na fázi buněčného cyklu a na míře oxidace (kyslíkový efekt). Se zvyšující se dávkou záření klesá počet kmenových nádorových buněk a zvyšuje se pravděpodobnost kontroly nádoru (tumor control probability - TCP) (1,2).
Účinek záření na tkáně má jistou prahovou dávku, s jejím růstem se zvyšuje pravděpodobnost a závažnost změn (deterministický, nestochastický účinek). Záření může mít také bezprahový (nedeterministický, stochastický) účinek na tkáně, typický pro genetické změny, které mohou mít za následek zářením indukované nádory (dlaždicobuněčné karcinomy, sarkomy). Toto riziko je však velmi malé – řádově v promilích. Minimální (TD5/5) toleranční dávka je dávka záření, která nezpůsobí více než 5 % závažných komplikací v průběhu pěti let po léčbě. Maximální toleranční dávka (TD5/50) způsobí u 50 % pacientů závažné chronické změny v průběhu 5 let po léčbě. Toleranční dávky jsou ovlivněny i dalšími faktory (velikost ozářeného objemu, frakcionací záření, kombinací s dalšími terapeutickými modalitami, věkem ozařovaného), proto se k výpočtu míry rizika poškození tkání používají různé radiobiologické modely (1).
Při plánování léčby se sledují toleranční dávky, i jak velký objem daného orgánu je dávkou ozářen (vztah objem-dávka, DVH - dose-volume histogramy) (8,9). Pro úspěch radiační léčby je důležité nejen ozáření nádorového ložiska dostatečnou dávkou, ale i ochrana okolních zdravých struktur, tzv. kritických orgánů. Podle uspořádání se tyto orgány dělí na sériové a paralelní. Ozáření těchto orgánů je limitováno výší dávky (sériové) nebo ozářeným objemem (paralelní). Podle léčebného záměru se radioterapie dělí na kurativní a paliativní. Ve vztahu k základní léčbě onemocnění, nejčastěji léčbě chirurgické, dělíme radioterapii na neoadjuvantní, adjuvantní a paliativní.
Nádory prsu
Radioterapie je indikována dle rozsahu choroby, typu operačního výkonu a dle stavu svodných lymfatik. Využívá se zevní radioterapie a brachyradioterapie. Primární radioterapie je indikována pro inoperabilní stadia, u lokálně pokročilého onemocnění (IIIA, B, C), u inflamatorního karcinomu, při nedostatečné odpovědi na neoadjuvantní chemoterapii či chemo-hormonoterapii nebo při jiných kontraindikacích operace, či při odmítnutí operace ze strany pacientky. Adjuvantní radioterapie je indikována u invazivních karcinomů po prs šetřící operaci, u radikálních výkonů závisí na T a N stadiu a stavu resekčních okrajů. Při radioterapii je ozařována oblast celého prsu s ev. ozářením svodných lymfatik (resp. hrudní stěny), popřípadě zakončená dozářením (boost) na oblast lůžka. Paliativní radioterapie se používá v případě lokálně pokročilého karcinomu prsu. Kritickými orgány jsou plíce, srdce, jícen, mícha.
Nádory vulvy
Primární radioterapie je indikována jako metoda volby u všech stadií, je-li kontraindikováno operační řešení pro vysoké operační riziko (věk, interní stav, interkurentní onemocnění). Dále je indikována jako metoda volby u stadia FIGO IV a v případě, že pacientka nesouhlasí s operačním řešením u stadia T1, T2 a T3. Neoadjuvantní RT je indikována u stadia T3 za účelem zmenšení nádoru a následně méně rozsáhlého operačního výkonu (radikální vulvektomie místo exenterace). Adjuvantní radioterapie je indikována dle výsledku histologického vyšetření z předchozí chirurgické intervence (pozitivita resekčních okrajů, pozitivita uzlin, lymfangioinvaze). Kombinace léčebných postupů se nezřídka používá pro pokročilá stadia. Při celkově špatném stavu pacientky volíme paliativní radioterapii (10). Kritickými orgány jsou rektum, močový měchýř a tenké střevo.
Nádory pochvy
Mezi léčebné postupy patří chirurgická léčba, někdy v kombinaci s adjuvantní chemoterapií, zevní radioterapie a brachyradioterapie. Intenzita pooperačního ozáření závisí na množství pooperačního rezidua. Kritickými orgány jsou rektum, močový měchýř a tenké střevo (8).
Nádory děložního hrdla
Primární radioterapie je indikována jako metoda volby od stadia IIB (zde v kombinaci s chemoterapií), od stadia IA a výše v případech, kdy je kontraindikace operační léčby nebo vysoké operační riziko (věk, interní stav pacientky, interkurentní onemocnění) a taky v situaci, kdy pacientka nesouhlasí s primárním operačním řešením. Adjuvantní radioterapie je indikována při pooperačně zjištěném postižení uzlin či parametrií, pozitivních okrajích a po neadekvátní operaci. U stadií IV se volí individuální postup s využitím paliativní radioterapie, chemoterapie či chirurgické léčby (11). Kritickými orgány jsou rektum, močový měchýř, tenké střevo a při ozařování paraaortálních uzlin také ledviny a mícha.
Nádory děložního těla
Terapeutickým postupem pro časná stadia I a II je chirurgická léčba. Dle přítomnosti rizikových faktorů (nádory grade 3, invaze přes polovinu myometria, velikost nádoru přes 2 cm, lymfovaskulární invaze, věk přes 60 let, postižení uzlin) je chirurgická léčba doplňována adjuvantní brachyradioterapií +/- zevní radioterapií. Právě pro riziko nežádoucích účinků zevního záření bylo v posledních letech vyvinuto úsilí vybrat skupiny pacientek, u kterých může být adjuvantní radioterapie vynechána bez zhoršení přežívání. Byly také stanoveny skupiny pacientek, kde by měla postačit samostatná adjuvantní vaginální brachyterapie, která oproti zevní radioterapii má mizivé riziko trvalé toxicity. U stadií III, IV se volí další postup (chemoterapie, typ radioterapie) dle provedené chirurgické léčby (radikalita chirurgické léčby, provedení či neprovedení lymfadenektomie). Při kontraindikaci chirurgického výkonu, odmítnutí operace a u inoperabilních nálezů se volí jiný léčebný postup, případně kombinace léčebných modalit. Kritickými orgány jsou rektum, močový měchýř, tenké střevo a při ozařování paraaortálních uzlin také ledviny a mícha (12).
Nádory ovaria
V současnosti je radioterapie pro nádorová onemocnění vaječníku omezena na paliativní a konsolidační terapii, k hypofrakcionaci pro lokální symptomatologii recidivy onemocnění, mozkové a kostní metastázy.
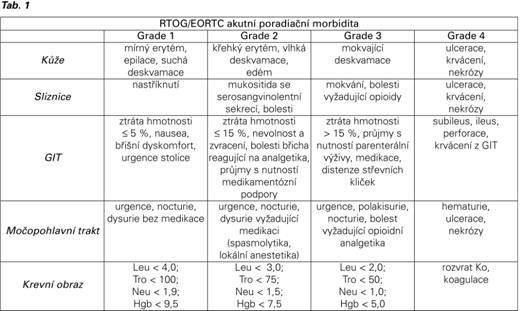
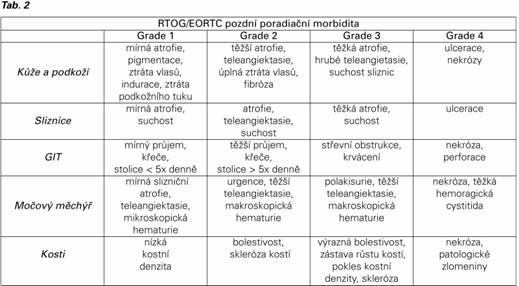
Podle doby nástupu a mechanizmu vzniku dělíme reakce na akutní (časné) a pozdní, podle rozsahu na lokální a systémové. Časné (akutní) radiační reakce jsou nejvýraznější v tkáních s rychle proliferujícími buňkami (kůže, sliznice, hemopoetický systém), které mají vysokou radiosenzitivitu (Tab. 1). Vznikají v průběhu ozařování a přetrvávají do 3 měsíců po jejím ukončení. Intenzita a trvání projevů závisí na rychlosti doplnění poškozených kmenových a diferencovaných buněk. Akutní nemoc z ozáření, stav, se kterým se naštěstí dnes již nesetkáváme, je odpovědí organizmu na jednorázové celotělové ozáření dávkami záření vyššími než 0,7 Gy. Projevuje se dřeňovým syndromem, radiační dermatitidou a gastrointestinální formou (1). Pozdní radiační reakce se vyskytují v tkáních s pomalu proliferujícími buňkami (podkoží, plíce, ledviny, mozek, kosti, svaly…). Vznikají postupně nebo náhle v průběhu měsíců až roků od ozáření. Na jejich vzniku má podíl imunitní reakce s produkcí cytokinů, které rozvíjí vznik fibrózy, ischémie a atrofie. Chronické změny jsou většinou ireverzibilní ( Tab. 2). Velmi pozdní reakce vznikají s odstupem let po ozáření na podkladě somatických a gametických mutací, které zapříčiní vznik sekundárních malignit. V prvních letech vznikají zejména hematologické malignity, později, s odstupem 10 a více let spíše solidní nádory. Proto je třeba velmi obezřetně indikovat ozáření v dětském, mladém a fertilním věku. Systémové (celkové) radiační reakce se vyskytují zejména při ozařování větších objemů a to již od počátku ozařovací série. Projevují se spíše nespecificky jako postradiační syndrom (únava, nechutenství, nevolnost, zvracení, rozladěnost). Přesný mechanizmus jejich vzniku není dosud zcela objasněn. Lokální (místní) radiační reakce se vyskytují pouze v ozařované oblasti. Pro každou ozařovanou oblast jsou určeny kritické orgány, tj. orgány s největším rizikem vzniku nežádoucích účinků (2,8). Akutní a chronické změny hodnotíme pomocí vytvořených skórovacích systémů, nejčastěji CTCAE (Common Terminology Criteria for Adverse Events), EORTC/RTOG (European Organisation for Research and Treatment of Cancer/Radiation Therapy Oncology Group) ( Tab. 1,2). K objektivnímu hodnocení celkového stavu pacientky slouží Karnofského index nebo WHO klasifikace. QoL (Quality of life questionaire), FACT (Functional Assessment of Cancer Therapy) a LENT SOMA (the Late Effects in Normal Tissues Subjective, Objective, Management, and Analytic) jsou nástroje, kterými sama pacientka hodnotí subjektivně-objektivně výskyt nežádoucích účinků (13,14).
Nežádoucí účinky na gastrointestinální trakt
K akutním gastrointestinálním nežádoucím účinkům patří velmi často urgence nebo inkontinence stolice, průjmy a krev ve stolici. Patogenetickým podkladem těchto změn je v akutní fázi smrt buněk ve střevních kryptách, následně vyvolaná zánětlivá reakce naruší slizniční bariéru a umožní průnik bakteriálních toxinů. Vrchol těchto reakcí je většinou ve 4.-5. týdnu radioterapie. Při dlouhodobé aktivaci cytokinového systému dochází k fibróze, endarteritidě s neovaskularizací, tedy ke vzniku chronických změn. Neovaskularizací vznikají teleangiektasie a při průchodu formované stolice způsobí krvácení. Fibrotické změny s nekrózou mohou vést ke vzniku píštělí a parciální střevní obstrukce (7,15).
Nežádoucí účinky na urogenitální trakt
Močová urgence, dysurie, infekce, ale i fibróza, stenóza, snížení kapacity močového měchýře, potíže při pohlavním styku patří mezi časté nežádoucí reakce postihující močopohlavní trakt. Vyskytují se ve více než 80 % případů, většina obtíží je však lehkého nebo středního stupně závažnosti. Uroteliální zánět s otokem vede k narušení fyziologické stavby stěny močového měchýře, ta se stane prostupnější pro bakteriální toxiny a vznikne infekce. Redukce objemu močového měchýře, uretrální nebo ureterální stenóza jako důsledek fibrózy, jsou známkami chronickými. Podkladem hematurie je obdobně jako u GIT vznik teleangiektasií.
Klinickým obrazem vaginální toxicity (narušení epitelu, zánět, ischémie a fibróza poševní stěny) je snížení elasticity, zkrácení délky pochvy, dyspareunie a ztráta sexuálního apetitu. U premenopauzálních žen je vysoké riziko ovariálního selhání a děložní insuficience při ozáření malé pánve. Při dávkách 250-300 cGy je inhibována ovariální funkce. Po dávkách 500-1 500 cGy dochází k dočasné infertilitě a přechodné hormonální nedostatečnosti. Nevratné ovariální selhání nastupuje po radiační dávce 2 000-3 000 cGy (elevace FSH a LH), proto před zahájením radioterapie lze u mladých nerodivších pacientek s méně rizikovými nádory zvažovat o transpozici ovarií, odběru oocytů, kryopreservaci ovariální tkáně nebo pacientku informovat o možnosti surogátního mateřství (7,16). Rizikem těchto výkonů může však být oddálení radikální radioterapie, proto nejsou vhodné zejména u pokročilejších a rychle rostoucích nádorů.
Nežádoucí účinky na kůži
Ionizující záření na kůži vede ke ztenčování epidermis, vzniku povrchových teleangiektasií, podkožní fibróze, erytému různého stupně, zánětlivé reakci. U pacientek po provedené radioterapii je vyšší riziko vzniku lymfedémů. Výjimečně se objeví ulcerace nebo nekrózy. Akutní, ale i chronické kožní změny se vyskytují nejčastěji při ozáření vulvy a třísel (7).
Nežádoucí účinky na kostní hmotu a dřeň
Narušením rovnováhy resorpce-formace kostní hmoty může v dlouhodobějším sledu způsobit patologické fraktury. Hematopoetické buňky kostní dřeně, kterých je v malé pánvi asi třetina, jsou velmi citlivé na akutní iradiaci (7). Nicméně při nejčastěji používaných schématech radioterapie nebývají poklesy počtu krevních elementů závažné vyjma radioterapie kombinované s konkomitantní chemoterapií.
Radioterapie je jednou z modalit léčby gynekologických malignit, která by neměla nahrazovat adekvátní operační řešení gynekologického tumoru. V léčbě časných stadií gynekologických nádorů je dávána přednost chirurgické léčbě. U lokálně pokročilejších nádorů však samotná chirurgická terapie nepřináší lepší léčebné výsledky ani nižší toxicitu léčby. Kombinací léčebných modalit se sice zvyšuje účinnost léčby, ale často za cenu vyšší toxicity. V některých případech je radioterapie jedinou kurativní metodou léčby, kdy určitá míra rizika i těžkých poléčebných komplikací je opodstatněná léčebným úspěchem při jinak fatálním dopadu nemoci. I přes veškerá opatření v průběhu radioterapie a vysokou přesnost metody dochází k akutním i pozdním nežádoucím účinkům okolních tkání, nejčastěji poškození kůže, gastrointestinálního traktu, močového a hematopoetického systému. Akutní nežádoucí účinky radioterapie projevující se během léčby jsou velmi časté zejména při primární radikální radioterapii či chemoradioterapii. Udává je až 90 % pacientek, většina z nich je však mírného a středního stupně a zhruba do 6 týdnů po ukončení léčby dochází k úplnému ústupu obtíží. Snahou ošetřujícího radiačního onkologa a spolupracující pacientky by měla být co možná nejlepší podpůrná léčba těchto obtíží, aby mohla být radioterapie dokončena do účinné dávky. Nejčastějšími závažnými akutními reakcemi, které mohou vést k předčasnému přerušení radioterapie či chemoradioterapie, jsou např. akutní gastroenteritida nereagující na podpůrnou terapii, závažná kožní toxicita při radikální radioterapii pro karcinom vulvy, leukopenie při konkomitantní chemoradioterapii pro karcinom děložního hrdla. Z pohledu kvality života jsou však závažnější pozdní nežádoucí účinky radioterapie, neboť tyto změny jsou trvalého charakteru. Opět platí, že valná většina i trvalých nežádoucích účinků je mírného až středního stupně závažnosti. Při správně prováděné radioterapii dle současných doporučených postupů by riziko trvalých nežádoucích účinků stupně 3 a 4 nemělo přesahovat 5 %. Mezi nejčastější závažné nežádoucí účinky, které pak ovlivňují negativně kvalitu života přežívajících pacientek, patří zejména: střevní obstrukce, střevní píštěl na podkladě nekrózy, hemoragická cystitida, vesikovaginální píštěl, patologické zlomeniny kostí v oblasti pánve.
Vzhledem k riziku zejména trvalých nežádoucích účinků je zcela zásadní, aby byla radioterapie indikována v souladu s nejnovějšími doporučenými postupy a individuálně diskutována v rámci mezioborové indikační komise pro gynekologické malignity - „tumor boardu“.