








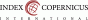

 Rada pro výzkum, vývoj a inovace: Seznam recenzovaných neimpaktovaných časopisů vydávaných v ČR
Oficielní časopis České společnosti pro ultrazvuk v porodnictví a gynekologii.
Rada pro výzkum, vývoj a inovace: Seznam recenzovaných neimpaktovaných časopisů vydávaných v ČR
Oficielní časopis České společnosti pro ultrazvuk v porodnictví a gynekologii.

V současnosti dělíme epiteliální nádory ovaria, tuby a peritonea z hlediska etiopatogeneze do dvou skupin, které se liší jak původem, tak biologickým chováním. Za prekurzor druhé skupiny, extrauterinních pánevních serózních karcinomů, je považován STIC – serous tubal intraepithelial carcinoma. Poznatky o etiopatogenezi této skupiny nádorů kladou nejen nové požadavky na diagnostiku, ale otevírají rovněž nové možnosti pro selektivní screening rizikových pacientek a také cílenou chirurgickou i onkologickou léčbu.
Nádory jsou tradičně primárně klasifikovány podle anatomické lokalizace a většina léčebných schémat rovněž respektuje toto anatomické členění. Pojem karcinom ovaria (nebo zhoubné nádory ovaria) představuje značně heterogenní skupinu nádorů jak co do histologických typů, tak i biologického chování. Přesto, že se často hovoří o nádorech ovaria, nezřídka tyto nádory pocházejí z tuby či (převážně pánevního) peritonea, což při pokročilém onemocnění mnohdy nelze přesně určit a pro pacientky toto určení původu nemá zásadnější význam. Karcinom ovaria je nejčastější příčinou úmrtí na gynekologické malignity v rozvinutých zemích včetně České republiky (ČR). V roce 2015 bylo v ČR zaznamenáno 1 023 nových případů a 734 zemřelých s diagnózou karcinom ovaria, což v hrubých číslech znamená incidenci 19,1 a mortalitu 13,7 (Graf 1) (1).
Graf 1 Ca ovarii - Incidence a mortalita v ČR
Ovariální tumory jsou velmi heterogenní skupinou onemocnění, která zahrnuje čtyři hlavní skupiny: epiteliální tumory, germinální tumory, gonadostromální tumory a sekundární tumory. Z primárních tumorů jsou epiteliální nejčastější a klinicky nejvýznamnější.
Dle v současnosti převládajících názorů můžeme epiteliální nádory ovaria, tuby a peritonea z hlediska patogeneze rozdělit do dvou skupin (2,3):
Karcinogenní sekvence HGSC nezahrnuje pouze samotný karcinom, ale také jeho prekurzory - p53 signature lession a serózní tubární intraepiteliální neoplazie (STIN), které se dále dělí na serózní tubární intraepiteliální karcinom (STICs, jde o karcinom in-situ) a méně výrazné, ale imunofenotypicky shodné serózní tubární intraepiteliální léze (STILs/TILTs/atypická hyperplazie) (7-8).
Prakticky všechny přímé prekurzory HGSC jsou postiženy mutací tp53 a vznikají především v oblasti distální tuby/fimbrií. Nádorové klony vždy obsahují mutaci specifických kodonů tp53. To je jedna ze základních podmínek pro diagnostiku lézí, kde jde o kombinaci imunohistochemických barvení (p53, bcl-2, MIB-1) a klasických nádorových cytologických změn (zvyšování nukleocytoplazmatického poměru, hyperchromní nepravidelná jádra, často s jadérky a nepravidelnou distribucí chromatinu, ztráta polarity buněk, vymizení dvou populací buněk – tj. řasinkových a sekretorních…). V případě časných lézí jsou ale cytologické známky minimální, popřípadě mohou zcela chybět (7,10).
Dále byly zjištěny další benigní léze, tzv. SCOUTs (secretory cell outgrowths), které nemají mutaci tp53, ale shodně s prekurzory a HGSC mají ztrátu exprese PAX2, která je spojena s buněčným dělením. Nejedná se tudíž o jednoznačné přímé prekurzory, ale léze vyskytující se častěji u starších postmenopauzálních žen spolu s HGSC. Jde spíše o prekancerózu v širším slova smyslu. Samotné SCOUTs se mohou dále dělit na typ 1 (z tubárních řasinkových a bezřasinkových buněk, imunofenotypicky s minimálními rozdíly od tubárních epitelií, jako je ztráta exprese ALDH1) a typ 2 (endometroidní s výraznějšími rozdíly, které mají i STINs, například EZH2, LEF1, RCN1, RUNX2, stathmin, beta-catenin barvící více jádro a cytoplazmu) (9-10).
Nové poznatky o etiopatogenezi ovariálních nádorů mají i výstupy do diagnosticko-léčebného procesu:
1) Určení místa původu nádoru
U již vzniklého extragenitálního high-grade serózního karcinomu nezáleží, zda prvotně pochází z ovaria, tuby nebo odkudkoli z pánevního peritonea. Přesné určení často ani možné není, protože nádor v době diagnózy postihuje všechny zmíněné struktury. Léčebná strategie i zásady jednotlivých modalit (chirurgického výkonu, chemoterapie) jsou stejné, ať zařadíme tumor kamkoli (11).
2) Vyšetření patologem – SEE-FIM protokol
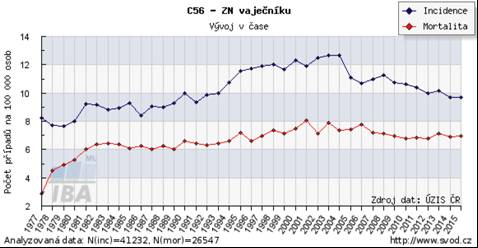
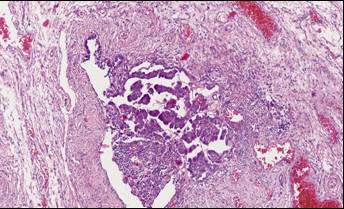
Nález STIC při adnexektomiích (salpingektomiích) prováděných pro benigní diagnózy není častý. Naproti tomu u risk-reducing (profylaktických) chirurgických výkonů není tento nález vzácností (10). Tato skutečnost si vyžádala změnu vyšetřovacího protokolu při vyšetření bioptického materiálu. Nejčastějším protokolem je SEE-FIM (sectioning and extensively examining the fimbrial end) (12), kde jsou transverzální řezy vejcovodem vedeny v 2-3mm intervalech. Vhodné je použití imunohistochemie s častým nálezem p53 mutací, někdy difuzní pozitivity WT1 a p16INK4. (Obr. 1, 2)
Obr. 1 Malé ložisko STIC fimbrií tuby s počínající invazí do stromatu, zvětšení 20x, barvení HE
Obr. 2 Malé ložisko STIC fimbrií tuby s atypickými hyperchromními jádry a pseudostratifikací, zvětšení 20x, barvení HE
3) Role ve screeningu
Systémový celoplošný screening ovariálního karcinomu dosud neexistuje. U vybraných skupin (nositelky hereditárního rizika – BRCA mutace, Lynchův syndrom atd.) jsou vypracovány protokoly pro selektivní screening (13), založené dosud hlavně na klasických vyšetřovacích metodách (fyzikální vyšetření, ultrazvuk, nádorové markery).
V současné době se rozbíhají studie, které jsou zaměřeny na cílenou identifikaci vysocerizikových pacientek pomocí detekce STIC buněk v genitálním traktu (BYFSTIC – hysteroskopicky asistovaný odběr kartáčkem přímo z vejcovodu; LUSTIC – výplachová cytologie děložní dutiny; LBC děložního hrdla) (Obr. 3), či v periferní krvi.
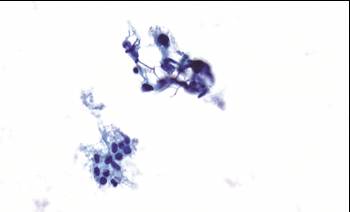
Obr. 3 Shluk atypických buněk s hyperchromními nepravidelnými atypickými jádry (nahoře) a shluk benigních epiteliálních buněk výstelky tuby (dole), zvětšení 40x, barvení Papa-Nicolau
4) Nález STIC u rrBSO (+ hysterektomie)
STIC je považován za přímý prekurzor pánevního serózního karcinomu. V případě provedení rrBSO (+ hysterektomie) je jeho výskyt udáván mezi 4 - 17 % (10). Vyvstává otázka, zda by pacientky s tímto nálezem profitovaly z adjuvantní chemoterapie. Na tuto otázku není v literatuře jednotný názor, v současnosti se většina autorů k podání chemoterapie nepřiklání (14).
5) Chemoterapie a biologická léčba
Rozlišení mezi low-grade a high-grade serózním karcinomem je primárně založené na stanovení mitotické aktivity a hodnocení buněčných atypií, užitečné je vyšetření p53. Toto rozlišení je podstatné jak pro určení prognózy, tak pro stanovení léčebné strategie u primárního onemocnění, ale i u recidiv. U extrauterinních pánevních serózních karcinomů je udávána léčebná odpověď na platinové deriváty (response rate – RR) ve 26 % u primárního onemocnění a mezi 27 – 66 % u recidiv (15). Na druhé straně, u low-grade serózních karcinomů jsou to 4 % pro primární onemocnění a 4,9 % u recidiv (16-17). U nositelek BRCA mutací se jako slibné jeví léčebné využití PARP inhibitorů.
Nové poznatky o etiopatogenezi epiteliálních nádorů ovaria, vejcovodu a peritonea ukazují na společný původ, molekulárně-genetické charakteristiky, biologické chování i prognózu řady z nich. Pro léčbu většinou není důležité, kde nádor vznikl, ale kromě rozsahu onemocnění rozhoduje především jeho přesný typ. Znalosti patogeneze otevírají nové možnosti pro selektivní screening rizikových pacientek a větší individualizaci léčby.