









 Rada pro výzkum, vývoj a inovace: Seznam recenzovaných neimpaktovaných časopisů vydávaných v ČR
Oficielní časopis České společnosti pro ultrazvuk v porodnictví a gynekologii.
Rada pro výzkum, vývoj a inovace: Seznam recenzovaných neimpaktovaných časopisů vydávaných v ČR
Oficielní časopis České společnosti pro ultrazvuk v porodnictví a gynekologii.

Ovariální karcinom je závažné onemocnění s vysokou mortalitou. Sporadické karcinomy tvoří většinu z diagnostikovaných případů. Hereditární formy, podmíněné zejména mutací v BRCA genech, pak tvoří kolem 15 – 20 % případů. Každé komplexní onkologické centrum by mělo disponovat definovaným systémem odborných ambulancí, které by zajišťovaly specializované dispenzarizační programy, konzultační činnost a indikace profylaktických operačních výkonů.
Ovariální karcinom je pátým nejčastějším nádorovým onemocněním u žen a je 4. nejčastější příčinou úmrtí na nádorové onemocnění. Podle nejaktuálnějších dat dostupných v registrech ÚZIS ČR bylo v roce 2015 zachyceno 19 nových případů na 100 000 žen, což v absolutních číslech znamená 1 023 nových případů karcinomu vaječníku a téměř 14 na 100 000 jich na toto onemocnění zemřelo (1). Za těmito čísly stojí zejména fakt, že téměř 75 – 80 % případů je diagnostikováno v pokročilém stadiu, tedy s velmi malou šancí na úplné vyléčení. Pětileté přežití je pak při maximálně vynaloženém léčebném úsilí kolem 30 – 40 % (2). Časná diagnostika je prakticky nemožná. Toto onemocnění zatím stále vzdoruje všem pokusům o vytvoření efektivního screeningového programu. U tří žen ze čtyř jde o high-grade nádor, který vzniká z prekurzorů, jejichž detekce je v současnosti prakticky nemožná, a progrese onemocnění je velmi rychlá (3). Příznaky nádorového onemocnění vaječníků jsou nespecifické a ženy často vedou nejprve k praktickému lékaři či na interní oddělení pro zažívací potíže. V době, kdy přijde na řadu gynekologické vyšetření, je již nádor většinou generalizovaný a diagnóza je stanovena využitím obligatorních vyšetření – klinický obraz/klinické vyšetření, expertní ultrazvukové vyšetření, biopsie a eventuálně odběr sérových nádorových markerů. Následný léčebný management je dílem spolupráce onkogynekologa a onkologa, tedy kombinace radikální chirurgické léčby a chemoterapie. Řadou studií ověřené schéma primární či intervalové radikální operace, při které je dosaženo nulového pooperačního nádorového rezidua, a chemoterapie založené na platinovém derivátu a taxanu, je zlatým standardem léčby posledních desetiletí (2). Vzhledem k nemožnosti časné diagnostiky a chybění nových lékových strategií se zásadním vlivem na přežití, je stále větší pozornost věnována preventivním strategiím.
Ovariální karcinom a zejména jeho nejčastější histologická varianta, high-grade serózní karcinom, je onemocnění s velkou frekvencí genových mutací. V roce 2011 bylo popsáno, že až 96 % těchto nádorů nese mutaci v genu p53. Z tohoto výzkumu pochází i upřesnění role BRCA1/2 genů, resp. jejich mutací, v souvislosti s karcinomem vaječníků (4). Další studium etiopatogenetických cest vzniku těchto malignit postupně vedlo k uplatnění poznatků např. ve vývoji nových lékových strategií či formování názoru na profylaktické výkony a jejich rozsah.
První zmínka o ovariálním karcinomu, jakožto částečně „dědičném onemocnění“, pochází již z roku 1866 (5). V současnosti mluvíme o hereditárním ovariálním karcinomu nejčastěji v souvislosti se syndromem dědičného karcinomu prsu a vaječníku (HBOC – hereditary breast and ovarian cancer syndrome). Tento syndrom je nejčastěji asociován s mutacemi v BRCA1 či BRCA2 genu. BRCA1/2 mutace jsou odpovědné cca za 40 – 50 % všech HBOC. Kolem 10 % těchto dědičných nádorů jde pravděpodobně na vrub mutacím v genech TP53, PTEN, PALB2, CHEK2 a STK11. Ostatní připadají na dosud neznámé genetické varianty či vzácné případy (6). Asi 15 – 20 % serózních karcinomů ovaria má dědičný podklad. BRCA geny patří mezi tumor-supresorové geny s vysokou penetrací a hrají významnou roli v opravě dvouvláknových zlomů DNA, tzv. homologní rekombinaci. K poruchám integrity buněčné DNA dochází denně a můžeme je počítat na tisíce. Pokud nedojde k opravě, nastane buněčná smrt. Mutace BRCA1/2 genů mají v běžné populaci prevalenci 1 na 600 – 800 osob. Jedinci se zárodečnou mutací BRCA1/2 genů mají zvýšené riziko vzniku zejména karcinomu prsu a vaječníku. Celoživotní riziko vzniku karcinomu prsu strmě stoupá od 20 let věku a dosahuje až 87 % bez ohledu na typ BRCA mutace. V běžné populaci s výskytem sporadického karcinomu prsu je toto riziko kolem 9 %. U karcinomu ovaria se liší riziko pro BRCA1 pozitivní pacientky, kde dosahuje 40 - 60 % a stoupá od 35 – 40 let věku, u BRCA2 pozitivních žen je 10 – 30 % a stoupá po 50. roce věku (7). V běžné populaci s výskytem sporadického karcinomu ovaria je toto riziko 1,8 %. Jedinci s mutací v BRCA genech jsou ale ohroženi i dalšími malignitami. Jedná se zejména o nádory slinivky břišní, kolorekta, žlučových cest, hrdla děložního a maligního melanomu, u mužů je navíc zvýšené riziko karcinomu prostaty.
Z výše uvedeného vyplývá nutnost specializované péče o nositelky zárodečných mutací BRCA genů. Každé onkogynekologické centrum by mělo disponovat ambulancí, která pečuje o tyto pacientky. Její náplní by měla být organizace spolupráce jednotlivých odborností (genetik, onkogynekolog, chirurg resp. plastický chirurg, onkolog, gastroenterolog, oční a kožní lékař a lékař kliniky zobrazovacích metod) a péče o pacientky s dědičnou dispozicí k nádorovému onemocnění. Zdravým či již nemocným ženám a dalším rodinným příslušníkům je nabízeno poradenství, genetické testování po konzultaci s genetikem a u pozitivně testovaných jedinců zařazení do sledovacích schémat a načasování profylaktických operací.
Preventivní gynekologické operace vycházejí ze základního předpokladu, že high-grade serózní karcinom vaječníku má svůj původ většinou ve tkáních epitelu vejcovodu. Až u 80 % BRCA pozitivních žen s high-grade serózním karcinomem je přítomna prekurzorová léze STIC (serózní tubární intraepiteliální karcinom) v distální části vejcovodu (3).
Profylaktické výkony na prsech jsou pak další velkou kapitolou.
Po dosažení věku, kdy začíná strmě narůstat riziko vzniku nádorového onemocnění, nabývá téma preventivních operací na důležitosti. Pokud pacientka operaci z jakéhokoli důvodu odmítá, je nezbytné ji upozornit na strmě rostoucí riziko vzniku této závažné malignity a pokračovat v pravidelném sledování ultrazvukovým vyšetřováním a odběrem nádorových markerů (minimálně CA125, eventuálně spolu s HE4) každých 6 měsíců. Pacientka musí být upozorněna, že tyto vyšetřovací postupy však nezajišťují časnou detekci karcinomu vaječníku a tím pádem nepřispívají k redukci mortality na toto onemocnění. V současnosti panuje obecná shoda na načasování profylaktické gynekologické operace – u BRCA1 pozitivních žen je to mezi 35. až 40. rokem života po ukončení reprodukčních plánů, u BRCA2 pozitivních je možné odložit řešení mezi 45. až 50. rok. Nicméně, až u 34 % těchto žen vznikne karcinom prsu před 50. rokem života, a proto i tyto ženy (zejména BRCA2 pozitivní) mohou profitovat z profylaktické operace provedené mezi 35. až 40. rokem života pro redukci rizika vzniku karcinomu prsu (7,8). Prsní operace – zda vůbec, jaký rozsah, načasování – se v současnosti stále více diskutuje.
Při vlastním gynekologickém operačním řešení, které by mělo proběhnout v onkogynekologickém centru, je preferován laparoskopický přístup a minimální rozsah zákroku, pečlivá explorace peritoneálních povrchů dutiny břišní, lavage a oboustranná adnexektomie. Ligamentum suspensorium ovarii by mělo být přerušeno 2 cm od pólu ovaria. Je nezbytné se vyvarovat termickému poškození ovaria i distálních částí vejcovodů, což by mohlo znemožnit detekci okultních lézí (9). Vejcovody by měly být histopatologicky vyšetřeny technikou SEE-FIM (Sectioning and Extensively Examining the FIMbriated End) (10), právě z důvodu pátrání po již přítomné prekurzorové lézi STIC či okultním karcinomu, který je možné najít až v 10 % případů (11). Pravděpodobnost okultního nálezu je větší u BRCA1 pozitivních pacientek ve srovnání s BRCA2 pozitivními (6 % vs. 4,2 %), zároveň u BRCA1 pozitivních lze tento nález očekávat v mladším věku. Zjištění malignity pak zásadně mění následný management. Benefit zjištění okultního nálezu ve srovnání s výkonem u symptomatické pacientky se odráží v 5letém přežití – 91,6 % vs. 54,4 %. BRCA1 pozitivní pacientka, která čeká s profylaktickým výkonem do 40 let věku, má riziko zjištění karcinomu vaječníku kolem 4 % (okultního při operaci či symptomatického kdykoli dříve), pokud čeká do 50 let, pak toto riziko vzroste na 14 % (12).
Problematika nálezu izolované léze STIC bez invazivní komponenty a její další management je kontroverzní.
Neexistuje žádný guideline. Náhodný nález STIC léze u dosud geneticky netestované pacientky při výkonu z benigní indikace by měl vést k indikaci genetického testování a následnému follow-up expertním sonografistou s odběrem nádorových markerů CA125 a event. HE4 a gynekologickému vyšetření každých 6 měsíců (13,14). Tento follow-up je o to důležitější u již BRCA pozitivně testovaných žen s izolovaným nálezem STIC bez invazivní komponenty, kde někteří autoři udávají riziko vzniku následného primárního peritoneálního karcinomu až 4,5 % (15). Radikální operační řešení či chemoterapie nemají v řešení STIC zatím své místo. Otázku optimálního managementu má odpovědět například běžící Pelvic-Ovarian carcinoma INTerception (POINT) projekt – registr založený ke sledování chování těchto prekurzorových lézí resp. pacientek s tímto nálezem. Výsledky by měly vést k získání chybějících dat, a tak ideálně k vytvoření guidelines péče o tyto pacientky.
Otázkou zůstává, zda k preventivní oboustranné adnexektomii připojit v jedné době hysterektomii či nikoli. Pro tento výkon hovoří několik argumentů. Odstraníme riziko vzniku nádoru děložního hrdla, jsou odstraněny i intramurální části vejcovodů, u žen bez anamnézy karcinomu prsu je možné v rámci hormonální substituce užívat pouze estrogenní preparáty, v případě již přítomného karcinomu prsu a probíhající hormonální léčbě Tamoxifenem odpadá riziko karcinomu endometria a v neposlední řadě by mělo odstranění dělohy přispívat k redukci rizika primárního peritoneálního karcinomu. Objevují se práce, které poukazují na mírně zvýšené riziko vzniku serózního karcinomu endometria u BRCA nosiček. Vycházejí však z limitovaného počtu případů (16). Proti hysterektomii hovoří následující argumenty: hysterektomie není nikdy nabízena jako alternativa odběru cytologie či první volba při zhoršené cytologii, dochází k prodloužení vlastního operačního zákroku a pacientku vystavujeme riziku možných peri a pooperačních komplikací z rozsahu výkonu. Ženám po oboustranné adnexektomii, s ponechanou dělohou a bez anamnézy karcinomu prsu, je možné a dokonce vhodné, nabídnout užívání hormonální substituční estrogen-gestagenní terapie do věku nástupu přirozené menopauzy, bez zvýšení rizika karcinomu prsu (17). Některé ženy špatně psychicky nesou odstranění zdravého orgánu, který je součástí jejich ženství. Indikace hysterektomie by tak měla vycházet z detailního poučení pacientky, jejího rozhodnutí a event. přidružených nálezů.
Profylaktická oboustranná adnexektomie vede ve svém důsledku až k 96% redukci rizika vzniku BRCA asociovaných gynekologických nádorových onemocnění. Přetrvává však malé riziko vzniku primárního peritoneálního karcinomu (3 – 4 %) (12,18-20). Původně uváděná až 50% redukce rizika karcinomu prsu po bilaterální ovarektomii u BRCA pozitivních pacientek byla v posledních letech několikrát zpochybněna. Nejprve velkou holandskou studií, která neprokázala žádnou redukci rizika karcinomu prsu po bilaterální adnexektomii ani u BRCA1 ani BRCA2 pozitivích žen (21) a v roce 2016 z velké prospektivní studie byl pozorován efekt bilaterální ovarektomie resp. adnexektomie na redukci rizika karcinomu prsu pouze u BRCA2 pozitivních žen do 50 let věku (8).
Pokud se na ovariální karcinom podíváme jako na onemocnění, jehož etiopatogenetická cesta je u velké většiny pacientek započata v ampulární části vejcovodu (3), nabízí se otázka, zda by nebylo dostačující, provést v rámci profylaxe pouze bilaterální salpingektomii resp. salpingektomii v první době a dokončení profylaktické operace (ovarektomie případně s hysterektomií) ve druhé době. Vzhledem k věku, kdy bychom měli BRCA pozitivním pacientkám profylaktický výkon provádět, bychom tímto přístupem zamezili vzniku nežádoucích projevů předčasné menopauzy se všemi přímými (akutní, subakutní a chronický estrogen-deficitní syndrom) i nepřímými (sexuální život, fungující partnerský vztah atd.) důsledky. Tímto tématem se zabývala řada prací (22-25). V současné době ještě probíhají studie, které si kladou za cíl na tuto otázku odpovědět (Holandsko - NCT02321228 - TUBA, MD Anderson – USA - NCT01907789, Francie - NCT01608074). V tuto chvíli nelze přijmout profylaktickou bilaterální salpingektomii jako standard péče o BRCA pozitivní pacientky. Problematická zůstává otázka již přítomného invazivního karcinomu, kdy riziko postižení vejcovodu a ovaria je 1:1. Riziko okultního karcinomu dosahuje 1,1 – 10 %. Ne všechny ovariální karcinomy, všechny histologické typy, mají svůj původ ve vejcovodu, a tedy tímto přístupem nedochází k tak významné redukci rizika jako při bilaterální adnexektomii. Zůstává nejednoznačně zodpovězená otázka možné předčasné menopauzy po bilaterální salpingektomii (26-28). V neposlední řadě, v případě ponechání ovarií, nedojde k redukci rizika karcinomu prsu – zejména u premenopauzálních BRCA2 pozitivních žen (8), byť byl tento efekt v poslední době zpochybněn.
Operačním výkonem péče o BRCA pozitivní pacientky v ambulanci gynekologa nekončí. Je nezbytné jim nadále věnovat zvýšenou pozornost. Pravidelné roční gynekologické kontroly by měly být doplněny expertním gynekologickým ultrazvukem pro trvající riziko vzniku primárního peritoneálního karcinomu.
Takto rozsáhlá péče je finančně a časově náročná a je tedy poskytována výhradně pacientkám pozitivně testovaným či s vysokým rizikem plynoucím ze zatížené rodinné anamnézy. Ke genetické konzultaci je však možné odeslat každou ženu. Genetik poté indikuje testování u jedinců, kteří splňují modifikovaná indikační kritéria NCCN, schválená Společností lékařské genetiky a genomiky ČLS JEP 2015. Jedná se o všechny ženy se sporadickým karcinomem vaječníků, vejcovodů či primárním peritoneálním karcinomem, a dále pak ženy s karcinomem prsu, kde jsou kritéria blíže specifikována ( Tab. 1) (29,30). Doporučení dále obsahuje kritéria pro familiární formy nádorových onemocnění se vztahem k BRCA mutacím (Tab. 1).
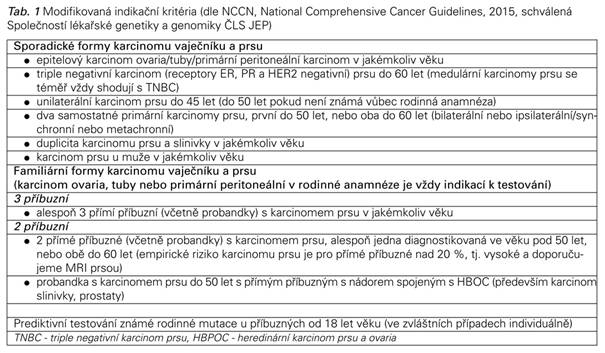
S rostoucím počtem indikací ke genetickému testování (Tab. 1) přibývá pozitivně testovaných jedinců. S vědomím výše uvedených dat jsou ženy konfrontovány se svým rizikem vzniku nádorového onemocnění a možnými profylaktickými operačními přístupy. Klinický management těchto pacientek je komplexní a vyžaduje zamyšlení nad riziky na straně jedné a kvalitou života na straně druhé. Operační řešení je nevratný zásah, který s sebou nese možnou operační morbiditu, symptomy estrogen deficitního syndromu a problémy týkající se „osobního resp. tělesného obrazu ženy“. Většina studií se však nezabývá otázkou kvality života. Veškerá data jednoznačně ukazují, že profylaktická oboustranná adnexektomie je ve srovnání s dispenzarizací vysoce efektivní v redukci rizika ovariálního karcinomu u BRCA pozitivních žen. K poklesu incidence a mortality karcinomu vaječníku dochází jak u BRCA1, tak u BRCA2 pozitivních žen, i když významnější pokles je patrný u BRCA1 pozitivních nosiček.