








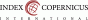

 Rada pro výzkum, vývoj a inovace: Seznam recenzovaných neimpaktovaných časopisů vydávaných v ČR
Oficielní časopis České společnosti pro ultrazvuk v porodnictví a gynekologii.
Rada pro výzkum, vývoj a inovace: Seznam recenzovaných neimpaktovaných časopisů vydávaných v ČR
Oficielní časopis České společnosti pro ultrazvuk v porodnictví a gynekologii.

Lymfocysta vzniká nahromaděním lymfy v retroperitoneu po provedené systematické pánevní a/nebo paraaortální lymfadenektomii. Obvykle vzniká do tří měsíců od operace. Většina lymfocyst je asymptomatických. Objemnější lymfocysty se mohou vyklenovat do malé pánve a utlačováním okolních struktur způsobit klinické obtíže. Ultrasonografie je zobrazovací metodou první volby, v jejímž obraze má lymfocysta charakteristický vzhled. U symptomatických lymfocyst je nutná léčba. Ta se řídí především velikostí a lokalizací lymfocysty, závisí také na zvyklostech a erudici pracoviště. Kromě laparotomického či laparoskopického přístupu lze využít i metody intervenční radiologie – punkci a drenáž pod ultrazvukovou kontrolou nebo aplikaci sklerotizujících látek do lůžka lymfocysty. Zvláštní strategii léčby vyžaduje infikovaná lymfocysta.
Lymfocysta je cystický útvar s fibrotickou stěnou bez epiteliální výstelky a cévního zásobení, vznikající nahromaděním lymfy po odstranění lymfatických uzlin nebo poškozením lymfatického systému. Lymfocysta vzniká v retroperitoneu jako komplikace provedené systematické pánevní a/nebo paraaortální lymfadenektomie v onkogynekologii.
Lymfa obsahuje jen malé množství trombocytů a koagulačních faktorů, lymfatické cévy navíc pro nedostatek hladké svaloviny nemají schopnost vazokonstrikce (1). Kombinace těchto faktorů neumožňuje lymfostázu, což může vést ke vzniku lymfocysty v prostorech po odstranění tukově lymfatické tkáně z retroperitonea (2).
Pokud dosáhne lymfocysta větších rozměrů, může se z retroperitonea vyklenovat do malé pánve, utlačovat okolní anatomické struktury a tím způsobovat klinické obtíže (3).
Nejčastěji vzniká lymfocysta během prvních tří měsíců po operaci, ojediněle se vyskytují i případy se vznikem po více než roce od provedené lymfadenektomie (4-6).
V dosud publikovaných studiích se výskyt lymfocyst po provedené lymfadenektomii udává ve velmi širokém rozmezí 1 - 58 % (5,7,8), což je dáno mimo jiné tím, že většina z nich se neprojevuje žádnými symptomy a nemusí být vůbec diagnostikována. Pouze menší část (5 - 35 %) způsobuje pacientkám klinické potíže (3,6,8,9), takové lymfocysty jsou pak vhodné k terapeutickému řešení.
Největší riziko vzniku lymfocyst je pozorováno po lymfadenektomii pro karcinom děložního hrdla, což se vysvětluje vlivem kombinace samotného odstranění uzlin a radikalitou výkonu na parametriích. Menší frekvence výskytu je pak u karcinomu ovaria a nejnižší u karcinomu děložního těla (3,4,9), avšak recentní práce na souboru 800 pacientek po onkogynekologických výkonech prokázala nejvyšší zastoupení symptomatických lymfocyst u ovariálního karcinomu (10).
Většina lymfocyst zůstává zcela asymptomatická a je pouze náhodným nálezem při pooperační kontrole. Na přítomnost lymfocysty mohou upozornit nespecifické obtíže pacientky jako bolesti břicha a podbřišku nebo symptomy z útlaku okolních struktur – střeva, močového měchýře. Bolesti v bedrech mohou být způsobeny útlakem močovodů a následným rozvojem hydronefrózy na dané straně. Nezřídka mohou způsobit také otok dolní končetiny a sekundárně vznik hluboké žilní trombózy, v případě infekce lymfocysty se může rozvinout až septický stav (3,8).
Nejčastěji jsou lymfocysty lokalizovány v pánvi (10) podél vena iliaca externa, především vlevo, dále ve fossa obturatoria (mezi vena iliaca externa a arteria obturatoria), méně pak kolem vena iliaca communis nebo dokonce kraniálněji paraaortálně či parakaválně (11).
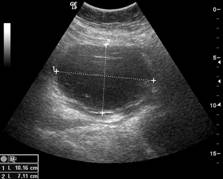
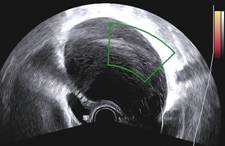
Zobrazovací metodou první volby v diagnostice lymfocyst je ultrasonografie. Detailní přehled o retroperitoneu získáme kombinací abdominálního a vaginálního, eventuálně transrektálního přístupu. V ultrazvukovém obraze je lymfocysta okrouhlá (Obr. 1) či oválná (Obr. 2) léze s tenkou stěnou, bez vaskularizace (Obr. 3), vyplněná tekutinou různé echogenity, nejčastěji anechogenního, méně často hypoechogenního či hyperechogenního vzhledu. U některých můžeme vidět tenká septa (Obr. 4) a debris (Obr. 5), u starších lymfocyst i kalcifikace ve stěně. Při infikování cysty se obsah jeví nehomogenní a ohraničení je neostré. Objevuje se prosáknutí okolních struktur a ultrazvukové vyšetření se stává značně bolestivým (11).
V CT obraze má lymfocysta hypodenzní obsah (- 18 HU). Je-li infikovaná, má většinou tenkou, nesourodou stěnu s nepravidelným sycením (až 25 HU) (12). Na snímcích z magnetické rezonance se lymfocysta zobrazuje jako hyperintenzivní struktura lobulárního tvaru. V T2 vážených obrazech má neznatelnou stěnu, v T1 vážených postkontrastních obrazech se její obsah nepatrně sytí (11).
Pro přesné zobrazení a stanovení počtu samostatných lymfocyst lze využít cystogram – nástřik kontrastní látky katetrem perkutánně zavedeným do lymfocysty. Na cystogramu se lymfocysty jeví jako lobulární útvary s pravidelnou stěnou (11).
I přesto, že výše uvedenými neinvazivními metodami lze lymfocysty spolehlivě diagnostikovat, při jakýchkoliv pochybnostech o povaze a původu zobrazené rezistence je vhodné jejich cytologické resp. histologické vyšetření.
Obr. 1 Okrouhlá unilokulární lymfocysta s hypodenzním obsahem

Obr. 2 Oválná unilokulární lymfocysta s ground glass obsahem
Obr. 3 Okrouhlá unilokulární lymfocysta s debris a ground glass obsahem bez vaskularizace
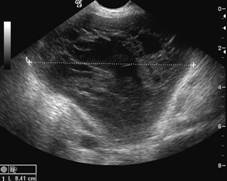
Obr. 4 Oválná unilokulární lymfocysta se septy a hypodenzním obsahem
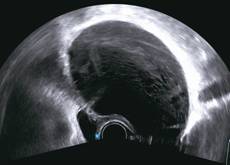
Obr. 5 Oválná unilokulární lymfocysta se septy, debris a hypodenzním obsahem
Asymptomatické lymfocysty nevyžadují žádnou intervenci a mohou se samy resorbovat, obvykle do dvou let od operace (13). Symptomatické lymfocysty vyžadují léčbu.
Metody intervenční radiologie
Prostá aspirace obsahu lymfocysty pod ultrazvukovou kontrolou má jen malou úspěšnost s vysokým rizikem recidivy (až 90 %) a zanesením infekce v 25 - 50 % případů (14). Výhodnější se zdá být perkutánně zavedený drén, který zůstává in situ průměrně 20 - 22 dní a odvádí nově se hromadící lymfu. Úspěšnost tohoto postupu se udává v 79 - 87 % (14,15). Podle zvyků pracoviště jsou možné modifikace tohoto postupu, které zkracují dobu zavedení katetru na 3 - 5 dní s antibiotickou podporou při zachování obdobné efektivity (16).
K dalšímu zlepšení efektu drenáže přispívá současná aplikace sklerotizujících látek do lůžka lymfocysty. Tyto sloučeniny způsobují obliteraci lymfatických cév a brání tak dalšímu úniku lymfy. Lze využít celou řadu látek: etanol, betadine, ampicilin, tetracyklin, doxycyklin, bleomycin, fibrinová lepidla, talek, polidokanolovou pěnu a další. Sklerotizace má úspěšnost 88 až 97 %, nejčastěji se používá etanol a betadine (17-18).
Chirurgická léčba
Metodou první volby chirurgické léčby byla dlouhou dobu laparotomie za účelem širokého otevření stěny lymfocysty umožňující odtok lymfy do dutiny břišní, odkud se lymfa může spontánně resorbovat peritoneem či omentem. V současnosti, kdy je snaha o miniinvazivní chirurgické přístupy, se jako metoda první volby nabízí laparoskopie. Tento přístup se jeví jako úspěšnější, s mnohem menším počtem recidiv (8 %) ve srovnání s laparotomií (16 %) nebo dokonce prostou aspirací (19-20). Největší limitací laparoskopie bývá přítomnost adhezí po předchozí radikální onkologické operaci. Zvýšená posto perační morbidita byla pozorována u pacientek po provedené paraaortální lymfadenektomii ve srovnání s pelvickou lymfadenektomií (20). Volba chirurgického přístupu by měla být přísně individuální, brát ohled na velikost a charakter lymfocysty, stejně tak na zvyklosti pracoviště a zkušenosti operujícího lékaře.
Infikovaná lymfocysta
Pokud dojde k sekundární infekci lymfocysty, je třeba zvolit odlišnou strategii léčby. V některých případech si vystačíme s konzervativním přístupem (aplikací širokospektrých antibiotik), díky kterému se lze vyhnout chirurgické intervenci. V případě nutnosti se preferuje perkutánní drenáž (vždy s antibiotickým krytím) před operační drenáží, jako prevence rozšíření infekce do dutiny břišní. Při přetrvávání příznaků infekce je ovšem nutný chirurgický zásah - fenestrace lymfocysty, evakuace jejího obsahu a odstranění co největší části její stěny. Pro velké riziko adhezí a větší přehled operačního pole je preferována laparotomie (11).
Lymfocysta je poměrně běžným nálezem u pacientek po radikální onkogynekologické operaci s odstraněním pelvických a/nebo paraaortálních uzlin. Většina z nich ovšem nezpůsobuje žádné klinické potíže, nevyžaduje léčbu a může se dokonce sama resorbovat. Symptomatické lymfocysty vyžadují léčbu. Způsobují potíže pacientky útlakem okolních struktur, mohou být příčinou dlouhodobé pooperační morbidity a příčinou oddálení adjuvantní onkologické terapie pacientky. Z těchto důvodů je zcela zásadní a nutné individualizovat radikální operační onkogynekologickou léčbu a v rámci širšího konsenzu a doporučených postupů sjednotit indikace k provádění systematické pánevní a/nebo paraaortální lymfadenektomie u jednotlivých onkogynekologických diagnóz. V současnosti probíhá klinická studie, která sleduje efekt úplného nahrazení systematické pánevní lymfadenektomie u karcinomu děložního hrdla exstirpací sentinelové uzliny/uzlin s jejich peroperačním histologickým vyšetřením a následným ultrastagingem. Koncept biopsie sentinelové uzliny je rovněž testován u časných stádií karcinomu endometria. Očekáváme výsledky studie zaměřené na možnost vynechání systematické lymfadenektomie u pokročilého ovariálního karcinomu bez suspektního uzlinového postižení při kompletním debulkingu v dutině břišní. Jedině touto cestou jsme schopni dlouhodobě minimalizovat morbiditu pacientek a zároveň zachovat onkologickou bezpečnost našich operačních výkonů.