








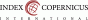

 Rada pro výzkum, vývoj a inovace: Seznam recenzovaných neimpaktovaných časopisů vydávaných v ČR
Oficielní časopis České společnosti pro ultrazvuk v porodnictví a gynekologii.
Rada pro výzkum, vývoj a inovace: Seznam recenzovaných neimpaktovaných časopisů vydávaných v ČR
Oficielní časopis České společnosti pro ultrazvuk v porodnictví a gynekologii.

Preeklampsie je pro těhotenství specifické multiorgánové onemocnění nejasné etiologie, které se podílí značnou měrou na mateřské a novorozenecké morbiditě a mortalitě, a proto je objektem mnoha studií. Následující článek si klade za úlohu nastínit určité aspekty problematiky tohoto onemocnění a současné možnosti predikce a prevence s jejich ověřením v klinické praxi na okresní úrovni v menší retrospektivní "Třebíčské studii", z které vyplývá, že screening preeklampsie má smysl.
Preeklampsie (PE) je pro těhotenství specifické multiorgánové onemocnění nejasné etiologie, které je nejčastěji charakterizováno jako hypertenze objevující se poprvé po 20. týdnu těhotenství a doprovázeno signifikantní proteinurií nad 300 mg bílkovin za den. Pro preeklampsii je nutná přítomnost placenty, nikoliv plodu a podílí se značnou měrou na mateřské a novorozenecké morbiditě a mortalitě. Manifestuje se obvykle ve III. trimestru a postihuje ve střední Evropě 4 – 8 % všech těhotenství (časná u 1 – 1,5 %, pozdní u 4 %). Současným trendem je rostoucí incidence vlivem potenciace rizikových faktorů, jako jsou dlouhodobé změny počasí, obezita, rostoucí věk rodiček, relativně větší zastoupení primipar. Z pohledu klasifikace hypertenzních poruch v graviditě rozlišujeme preeklampsii mírnou (TK 140/90 - 159/109 mmHg, proteinurie 0,3 – 5 g za 24 hod) a těžkou (TK > 160/110 mmHg, proteinurie > 5 g za 24 hod, epigastrická bolest či bolest v pravém hypochondriu, cefalea, poruchy vizu nebo HELLP syndrom - hemolýza, elevace jaterních enzymů, trombocytopenie), preeklampsii superponovanou (nasedající na chronickou hypertenzi), nebo časnou a pozdní. Časná preeklampsie se klinicky manifestuje před 34. t.t. (early onset preeclampsia EO-PE), je etiologicky spjata s poruchou fetoplacentární jednotky a je typicky spojena s dysfunkcí placenty, intrauterinní růstovou restrikcí plodu (IUGR), sníženým objemem placentární tkáně, abnormálními nálezy průtoků na uterinních a umbilikálních tepnách při dopplerovském vyšetření, závažnou mateřskou a neonatální morbiditou a mortalitou. Pozdní preeklampsie (late onset preeclampsia LO-PE) většinou vzniká na podkladě chronického onemocnění matky a je spojena s normálním nebo zvětšeným objemem placentární tkáně, fyziologickým růstem plodu, fyziologickým nebo mírně abnormním nálezem průtoků při dopplerovských vyšetřeních, příznivou prognózou pro matku i plod (1). V některých literárních zdrojích se můžeme setkat i s termínem střední preeklampsie (preterm - manifestující se před 37. t.t.).
Etiopatogeneze není prozatím definitivně objasněna. Etiologicky se na vzniku preeklampsie podílejí:
Dle současných poznatků o patogenezi při normálním vývoji placenty dochází k invazi buněk cytotrofoblastu do mateřských spirálních cév a náhradě hladkých svalových buněk v těchto cévách. Cévy se tak stávají nízkoodporové vysokokapacitní a nereagují vazokonstrikčně, dochází k tzv. remodelingu arterií, který začíná na konci I. trimestru a končí kolem 18. až 20. t.t. Při preeklampsii vlivem neobjasněné příčiny dochází k narušení tohoto procesu a k nedostatečnému remodelingu spirálních arterií, které mohou reagovat vazokonstrikčně, a to vede k redukci průtoku placentou. Redmanova hypotéza vysvětluje preeklampsii jako 2stupňovou poruchu. V preklinickém (placentárním) stadiu snížení perfuze placentou vede ke tvorbě množství biologicky aktivních působků, které vstupují do mateřské cirkulace a mohou způsobovat rozsáhlou endotelovou dysfunkci. Navazující klinické (maternální) stadium se projevuje generalizovanou vazokonstrikcí, ak tivací koagulační kaskády, pravděpodobně tvorbou mikrotrombů a redukcí intravaskulárního objemu (vlivem hypoalbuminémie a úniku tekutiny extravaskulárně při zvýšené permeabilitě cévní stěny), hypertenzí, a to má za následek generalizovanou redukci perfuze orgánů. Spojkou mezi 1. a 2. stadiem jsou v placentě vzniklé – cytokiny, antiangiogenní faktory, mikropartikule syncytiotrofoblastu, reaktivní metabolity O2, volné radikály (1,6). Výše popsané změny rezultují v námi obávané komplikace maternální (eklampsie, intrakraniální krvácení, retinální edém, plicní edém, srdeční selhání, akutní renální selhání, hepatopatie, DIC, ...) a fetální (abrupce placenty, IUGR, předčasný porod, intrauterinní úmrtí plodu) (7).
Vzhledem k závažnosti preeklampsie a HELLP syndromu je jednou z priorit moderní perinatologie snaha o pochopení jejich patofyziologických mechanizmů a nalezení vhodných screeningových testů k časné identifikaci žen s rizikem rozvoje těchto komplikací, které by mohly následně profitovat z dispenzarizace a časné léčby. V praxi se k tomu používají různé markery, a to: 1) hodnocení anamnestických rizikových faktorů, 2) biofyzikální – jako střední arteriální tlak (MAP = dTK + { ( sTK – dTk ) : 3 }) a dopplerovské UZ měření uterinních arterií, 3) biochemické (PAPP-A, PlGF, sFlt, ...).
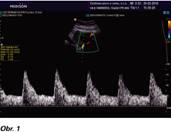
Dopplerovské zobrazení a flowmetrie uterinních arterií (PI UtA) je neinvazivní metoda nepřímo hodnotící utero-placentární (U-P) cirkulaci v průběhu I., II., ev. III. trimestru. U preeklampsie a často i IUGR abnormální placentace rezultuje v inadekvátní U-P perfuzi. Nízký enddiastolický tok a pokles toku v časné diastole (přítomnost zářezu, tzv. notch) můžeme vidět v uterinních arteriích u netěhotných žen nebo v I. trimestru, pokud přetrvává notch v II. trimestru (zejména po 24. t.t.), tak je nález asociován s inadekvátní trofoblastickou invazí (1,6). Normální flowmetrie UtA (viz Obr. 1). Hodnoty PI UtA se během gravidity postupně snižují, kolem termínu porodu se mohou nepatrně zvýšit. Kolem 10. týdne gravidity je normální hodnota asi 2,5, v 16. t.t. je to 1,5, ve 24. t.t. 1,0, a ve 38. t.t. 0,8 (v praxi přes kalkulátory přepočítáno na MoM) (8). Při hodnocení nálezu je důležité zohlednit fakt, že na průtok krve dělohou mají vliv 3 faktory – arteriální TK, venózní TK a cévní rezistence. Při preeklampsii vysoká rezistence v UtA má za následek abnormální tvar křivky, pro který je typický vysoký PI UtA a přítomnost notchu (viz Obr. 2). Na základě metaanalýzy 74 studií (9) abnormální UZ nález v I. a zejména ve II. trimestru je považován za vhodný screeningový test závažnosti a progrese preeklampsie i IUGR. Přítomnost notch v UtA v III. trimestru po 28. t.t. vypovídá o riziku pozdní PE.
Preklinickou známkou endotelové dysfunkce u preeklampsie jsou změny v hladinách cirkulujících faktorů v séru těhotných žen. Dochází k poklesu pro-angiogenních faktorů jako VEGF (vascular endothelial growth factor), PlGF (placental growth factor), TGFbβ (transforming growth factor beta) a vzestupu faktorů s anti-angiogenním účinkem sFLT-1 (soluble fms-like tyrosine kinase-1, váže VEGF a PlGF), sEng (soluble endoglin, ↓↓ vazodilatační účinek NO). Klinicky význam mají i PP13 (placental protein 13), PAPP-A (pregnancy-associated plasma protein A, významně snížená hladina v I. trimestru je spojena s rizikem PE), Inhibin A a Aktivin A (1).
Izolovaně mají markery nízkou prediktivní hodnotu, proto mnoho studií ověřuje jejich různé kombinace. Dle FMF studie (10) vyplývá jako nejefektivnější screening preeklampsie pro jednočetné gravidity 2kroková strategie, při které se v 1. kroku snažíme o predikci již koncem I. trimestru vzhledem k malým možnostem prevence, k zahájení tzv. ASA protect před 16. t.t. a je cílený na časnou preeklampsii. Nejúčinnější prediktivní test v I. trimestru (gr. h. 11+0- 14+1) je kombinace anamnéza + MAP + PI UtA + PAPP-A a PlGF (DR 89% pro EO-PE, 75% preterm-PE (< 37. t.t.), 47% term-PE (≥ 37. t.t) při FPR 10%) (11,12). V II. trimestru (gr. h. 19+0-24+6) je nejúčinnější prediktivní test kombinace MAP + PI UtA + poměr sFLT-1/PlGF ve 24. t.t. (DR 99 % pro EO-PE, 85 % preterm-PE, 46 % term-PE při FPR 10 %) (13). 2. krok je cílený na rizikové pacientky v III. trimestru, na predikci pozdní preeklampsie a k eventuálnímu zahájení časné terapie. Využívá stejnou kombinaci markerů jako v II. trimestru (pro screening v gr. h. 30+0-34+6 je DR 98 % preterm-PE, 60 % term-PE, pro gr. h. 35+0-37+6 je DR 85 % term-PE při FPR 10 %) (14,15). Dle studie PROGNOSIS, která hodnotí soubor pacientek s jednočetnou graviditou od gr. h. 24+0 až 36+6, je možno zavedením predikčních markerů do klinické praxe snížit délku hospitalizace až o polovinu, a to vede k úspoře nákladů. K rychlému managementu PE v klinické praxi může posloužit poměr sFLT-1/PlGF s vysokou negativní prediktivní hodnotou testu 99,3 % při cut-off pod 38 u těhotných se známkami a symptomy PE nebo u asymptomatických se zvýšeným rizikem rozvoje PE (16).
Primární prevence s ohledem na neobjasněnou příčinu vzniku preeklampsie prozatím není možná. Predikcí rizikové skupiny těhotných jsme schopni sekundární prevence, a to využitím kyseliny acetylsalicylové (ASA), která ovlivňuje agregaci trombocytů přes lokálně působící prostaglandiny – Prostacyklin vs. Tromboxan. Nízké dávky ASA inhibují aktivitu cyklooxygenázy s následným snížením tvorby Tromboxanu a relativní převahou Prostacyklinu, který má mohutný antiagregační a vazodilatační účinek a vede k lepšímu prokrvení dělohy. Dle Cochrane databáze zahájení ASA protect před 16. gestačním týdnem vede k redukci výskytu o 19 % u PE, o 8 % u předčasného porodu. Ženy se středním nebo vysokým rizikem rozvoje časné PE by mohly profitovat z ASA, která vede k významné redukci zejména těžké preeklampsie, méně pak i prosté gestační hypertenze (1). Dle dosud dostupných informací zahájení ASA protect po 16. t.t. pravděpodobně vede ke snížení rizika PE o cca 10 % (17,18) a má svoje opodstatnění v případě klinických známek PE a/nebo pozitivního prvotrimestrálního screeningu na PE. Doporučená dávka ASA je minimálně 100 mg/D večer do 32. až 34. t.t. vzhledem k aktivaci endotelových funkcí večer a v noci (1,19).
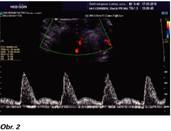
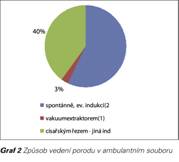
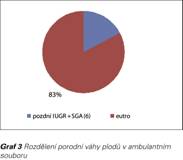
Přístup k informacím na ambulantní i nemocniční úrovni nabízel možnost ověřit si význam predikce a prevence preeklampsie v klinické praxi na okresní úrovni v menší retrospektivní studii. V ambulantním Centru péče o ženu v Třebíči bylo od 22.10.2013 do 22.2.2016 vyšetřeno v rámci prvotrimestrálního screeningu se stanovením rizika preeklampsie 782 klientek (narozených 1969 až 1996) s jednočetnou graviditou na základě kombinace markerů anamnéza + MAP + PI UtA + PAPP-A. Jako cut-off rizika byla použita dle nastavení Astraie hranice 1:100 (při cut-off rizika 1:105 je DR 81,8 % pro časnou PE při FPR 5 %, při 1:216 je DR 92,5 % při FPR 10 %) (20). V ambulantním souboru vyšetřených klientek bylo 36, které měly cut-off ≥ 1:100 (4,6 %) a které od zjištění začaly užívat ASA 100 mg/den do 32. t.t. U jedné klientky nastal v 15. t.t. missed abortion, u 35 klientek gravidita skončila porodem vitálních plodů. U 18 z nich byla gravidita bez hypertenzní poruchy, u 10 se vyvinula gestační hypertenze, u 6 přetrvávala chronická hypertenze a jenom u 1 klientky se vyvinula mírná pozdní preeklampsie (3 %) (viz Graf 1). Z pohledu ukončení gravidity 20 rodiček porodilo spontánně, ev. indukcí, 1 vakuumextraktorem, 14 císařským řezem – z toho ani jedna primárně pro preeklampsii, ale pro přidruženou indikaci typu selhání indukce, stav po 1-2x SC, deflexní poloha hlavičky, akutní hypoxie (viz Graf 2). 6 rodiček porodilo hypotrofický plod (LO-IUGR + SGA), 29 eutrofický plod (viz Graf 3). V souboru byly 3 klientky po IVF, 7 mělo BMI ≥ 35, 6 klientek se léčilo s chronickou hypertenzí, antihypertenzní terapie po puerperiu de novo zůstala u jedné klientky.
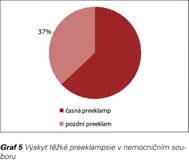
Průzkumem příslušné dokumentace Gynekologicko-porodnického oddělení Nemocnice Třebíč v čase, kdy přibližně mohl rodit soubor klientek z ambulantní skupiny, tedy od 1.4.2014 do 24.5.2016, se vybrala skupina všech rodiček, které byly bez anamnézy preventivní ASA medikace a u kterých se rozvinula preeklampsie. V daném období ze souboru 2 613 porodů výše uvedenou podmínku splňovalo 22 rodiček (0,84 %). U 3 z nich se vyvinula mírná preeklampsie a porodily spontánně indukcí, u 19 z nich pro těžkou PE byla gravidita ukončena císařským řezem (viz Graf 4), z toho u 12 z nich se jednalo o časnou těžkou PE, u 7 o pozdní těžkou PE (viz Graf 5).
V nemocničním souboru rodiček bylo 5 rodiček z Centra péče o ženu Třebíč. Jedna z nich se nedostavila na I. screening, u dvou byla dvojčetná gravidita (gemini bi-bi), u posledních dvou byl cut-off 1:161 a 1:325 a rozvinula se u obou těžká časná preeklampsie. Změnou cut-off rizika na 1:216 by se tak v daném souboru zachytilo o jednu klientku více.
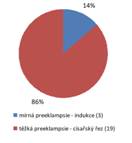
Graf 4 Typ preeklampsie a způsob vedení porodu v nemocničním souboru
I na tak počtem pacientek malé studii je patrný pozitivní efekt sekundární prevence, který je ve shodě se závěry v Cochrane databázi, tedy že screening preeklampsie má smysl. Z pohledu hodnocení souboru je nutno vzít v potaz lokoregionální rozdíly – různě zdravá populace v ČR, i možnost podhodnocení mírné pozdní preeklampsie a její vedení v dokumentaci porodnice jenom jako prosté gestační hypertenze. V běžné praxi v rámci kombinovaného I. screeningu stojí za povšimnutí možnost kalkulace rizika preeklampsie kombinací anamnéza + PI UtA + MAP + PAPP-A (při cut-off 1:216 je DR časné preeklampsie 92,5 % při FPR 10 %) bez zvýšení provozních nákladů, nebo dle FMF doporučovaná kombinace, která vyžaduje k výše uvedenému navíc odběr PlGF (při cut-off 1:269 je DR 96,3 % při FPR 10 %) (20). V II. a III. trimestru v selektované populaci těhotných může posloužit v praxi poměr sFLT-1/PlGF s vysokou negativní prediktivní hodnotou k rychlému managementu preeklampsie, ke stanovení možností další dispenzarizace, včasnému záchytu hrozících komplikací a k plánovaní terapie a porodu, ev. transportu intra utero na vyšší pracoviště.