









 Rada pro výzkum, vývoj a inovace: Seznam recenzovaných neimpaktovaných časopisů vydávaných v ČR
Oficielní časopis České společnosti pro ultrazvuk v porodnictví a gynekologii.
Rada pro výzkum, vývoj a inovace: Seznam recenzovaných neimpaktovaných časopisů vydávaných v ČR
Oficielní časopis České společnosti pro ultrazvuk v porodnictví a gynekologii.

Management hypertenze v těhotenství při suspekci na preeklampsii je obtížný a ekonomicky náročný, vzhledem k tomu, že dosud chyběl biomarker predikující rozvoj této závažné těhotenské patologie. Několik prospektivních multicentrických studií poukazuje na možnost predikce pomocí stanovení sérových hladin cytokinů podílejících se na angiogenezi. Na základě poznatku o důležitosti těchto cytokinů v etiopatogenezi preeklampsie byly vyvinuty automatizované imunochemické metody použitelné v klinické praxi. Výsledky těchto studií prokázaly vysokou negativní prediktivní hodnotu tohoto testu, umožňující bezpečně propouštět těhotné do ambulantní péče minimálně na jeden týden. Součástí tohoto přehledového článku je i současné konsenzuální stanovisko předních světových odborníků na angiogenní markery, týkající se implementace testování rizika rozvoje preeklampsie pomocí imunochemického testu do klinické praxe.
Skupina hypertenzních chorob vyskytujících se v graviditě je jedním z příkladů mezioborové problematiky, se kterou se setkáváme v průběhu asi 10 % všech těhotenství. Populační riziko preeklampsie (PE), jakožto jednoho z představitelů této skupiny, činí 2-8 % (1). Základem úspěšné léčby a dobrých léčebných výsledků je správná a především časná diagnóza tohoto patologického stavu těhotenství. Z tohoto klinického hlediska je důležité odlišení PE od dalších onemocnění spojených s hypertenzí v graviditě. Nemalou roli hrají i socioekonomické faktory (především délka hospitalizace, ale i rozsah a četnost laboratorních vyšetření vedoucích k diagnóze a lékařskému rozhodnutí o dalším postupu). Důležitým pomocníkem v tomto směru jsou nové biochemické markery, pomocí kterých se dá predikovat další vývoj hypertenzního stavu těhotné. Zavedením nových predikčních markerů PE do klinické praxe se dá snížit délka hospitalizace až o polovinu, a například v Anglii se tímto dá ušetřit cca 28 mil. liber ročně (2), což pouhou extrapolací na populaci ČR činí kolem 200 mil. Kč ročně.
Celosvětově se odhaduje, že PE je příčinou až 42 % úmrtí těhotných. Vzhledem k tomu, že momentálně je jedinou “léčbou” PE porod, patří mezi hlavní příčiny iatrogenních prematurit, kdy její odhadovaný celosvětový podíl na všech předčasných porodech činí kolem 15 % (3).
K hlavním rizikovým faktorům PE patří:
Na druhé straně nepřítomnost preeklampsie v předchozí graviditě snižuje riziko rozvoje PE v dalším těhotenství, kdy se předpokládá ochranný vliv minimálně 3 roky. Stejně tak vyšší výška těhotné snižuje riziko preeklampsie (4,5,6).
Současný management hypertenze v těhotenství byl podrobně popsán již dříve (7). Zatímco některé patologické stavy v těhotenství související s arteriální hypertenzí nesnesou odklad (např. HELLP syndrom) a jejich jediným řešením je neprodlené ukončení gravidity, jiné hypertenzní stavy (např. preexistující arteriální hypertenze) mohou při nasazení adekvátní antihypertenzní terapie a adekvátního ambulantního sledování stavu matky a plodu vést až k termínovému porodu. Bohužel PE nepatří ani do jedné z těchto skupin – na jednu stranu mírná PE není indikací k okamžitému ukončení gravidity, na druhou stranu ambulantní sledování těhotné s jasnými klinickými známkami PE ohrožuje těhotnou i plod. Management PE jsme popsali v přehledové práci (8), kde jsme uvedli i aktuální možnosti její predikce a prevence.
Symptomatologie PE je pestrá a nespecifická, mezi hlavní symptomy patří zejména:
Hlavním úkolem u hospitalizovaných těhotných je rozlišení konkrétní hypertenzní poruchy ve smyslu možnosti predikce rozvoje PE v terénu již rozvinuté arteriální hypertenze, nehledě na to, zda se jedná o preexistující či gestační hypertenzi. Samotná měření krevního tlaku spolu s hodnotami proteinurie mají velmi nízkou pozitivní predikční hodnotu – pouze kolem 20 % (9). V praxi to znamená, že za současného stavu medicíny až u 80 % těhotných, které jsou hospitalizované s elevací krevního tlaku pro vyloučení PE, se žádná PE nevyvine. Navíc pro validní kvantifikaci proteinurie je nutno provést 24hodinový odběr moči (většinou od rána dalšího dne) s další několikahodinovou prodlevou související s transportem vzorku do laboratoře a jeho zpracováním. Reálně to znamená minimálně o jeden den delší hospitalizaci, ale většinou to bývá dnů několik.
Etiopatogeneze PE je multifaktoriální a není dosud kompletně objasněná. Vzhledem k současně existujícím vědeckým poznatkům jako nejperspektivnější a nejpravděpodobnější teorií se jeví teorie poruchy rovnováhy angiogenních faktorů. PE vzniká na úrovni placentární mikrocirkulace a toto tvrzení je podpořeno tím, že PE se může rozvinout i v případě molární gravidity. Tato placentací podmíněná patologie je charakterizovaná antiangiogenním stavem. Hlavní faktory této angiogenní dysbalance jsou uvedeny v Tab. 1. Na jedné straně to jsou faktory podporující angiogenezi jako: placentární růstový faktor (placental growth factor, PlGF), vaskulární endotelový růstový faktor (vascular endothelial growth factor, VEGF) a transformující růstový faktor b (transforming growth factor b, TGFb ). Na straně druhé jsou faktory antiangiogenní jako: solubilní fms- like tyrozinkináza 1 (sFlt-1) a solubilní endoglin (sEng).
V případě PE dochází ke snížení plasmatických hladin volných (bioaktivních) proangiogenních faktorů tím, že jsou navázané na sebe zvýšeným množstvím antiangiogenních molekul, které mají vysokou afinitu k proangiogenním molekulám (10). Snižování plasmatických koncentrací solubilních forem proangiogenních molekul vede k endoteliální dysfunkci a ke klinickým obrazům PE (11,12,13). Tato myšlenka je podpořena pozorováním přítomnosti symptomů podobným PE (preeclampsia-like syndrome) v případě onkologických pacientů léčených antiangiogenní biologickou léčbou integrovanou do chemoterapeutických režimů (14,15).
Tab. 1 Hlavní proangiogenní a antiangiogenní molekuly regulující angiogenní homeostázu
|
Proangiogenní |
Antiangiogenní |
|
PlGF (placental growth factor) VEGF (vascular endothelial growth factor) TGFb (transforming growth factor b) |
sFlt-1 (soluble fms-like tyrosine kinase 1) sEng (soluble endoglin) |
Zjištění, že v patogenezi preeklampsie hrají důležitou roli cytokiny ovlivňující angiogenezi, otevřelo nové velice zajímavé možnosti. Na jednu stranu je to možnost časné predikce vývoje PE na základě vyšetření plasmatických hladin těchto cytokinů (viz níže), a na straně druhé – konečně možnost cílené léčby PE. Experimentální cílenou léčbou PE se od roku 2011 zabývala zatím pouze jedna pilotní studie – RAAPID, jejíž velice slibné a zajímavé výsledky byly nedávno publikovány (16). Studie popisuje možnost, účinnost a bezpečnost aferetického odstranění antiangiogenního sFlt-1 z krevního oběhu těhotných s klinickými známkami PE (elevace TK, proteinurie nad 300 mg/l), a poměrem sFlt-1/PlGF > 85. Ve výsledkové části tohoto projektu je porovnána délka pokračování gravidity po aferéze u žen, které ji podstoupily, s délkou pokračování gravidity v kontrolní skupině těhotných (které aferézu nepodstoupily). Zatímco v kontrolní skupině (n = 22) medián délky těhotenství po zařazení do studie činil 3 dny (0–14 dní), ve skupině, která podstoupila aferetické odstranění sFlt-1 jednou (n = 6), byl medián 8 dní (2–11 dní), a ve skupině, kde aferéza byla provedená celkem 2krát (n = 4) nebo 3krát (n = 1), činil medián 15 dní (11–21 dní). Ve všech případech byla, tato léčba dobře tolerovaná jak těhotnou, tak i plodem a nebyly pozorovány žádné nežádoucí účinky. Nicméně tato pilotní studie musí být samozřejmě ještě potvrzená větší randomizovanou studií.
Poznání úlohy angiogenních faktorů jako mediátoru PE vedlo k jejich využití v roli časných prediktorů rozvoje této patologie těhotenství. Změny jako zvýšené hladiny sFlt-1, snížené hladiny PlGF, a tím pádem i zvýšený poměr sFlt-1/PlGF jsou detekovatelné v sérech těhotných, kterým byla diagnostikovaná nejen PE, ale i růstová retardace plodu (IUGR) nebo intrauterinní úmrtí plodu, přičemž tyto změny korelují s vážností klinického projevu těchto patologických stavů. Čím časnější je patologie gravidity, tím markantnější je dysbalance angiogenních faktorů. Dalším důležitým zjištěním je to, že dysbalance angiogenních faktorů je detekovatelná v sérech těhotných ještě před začátkem manifestace klinických příznaků onemocnění (12,17). Úspěchem skončila i snaha o stanovení diagnostických a klinicky využitelných hraničních hodnot pro poměr sFlt-1/PlGF v závislosti na gestačním stáří (18).
Již v roce 2010 vyšla řada prací vyhodnocujících bezpečnost a efektivitu stanovování sérových hladin sFlt-1 a PlGF pomocí automatizovaných imunochemických testů Elecsys® (3,19,20). Možnost rychlého vyšetření (výsledky do 20 minut) ze séra dělá z těchto testů (a zejména ze stanovování poměru sFlt-1/PlGF) velice užitečný nástroj pro klinickou praxi při potřebě rychlého rozhodování v rámci managementu preeklampsie.
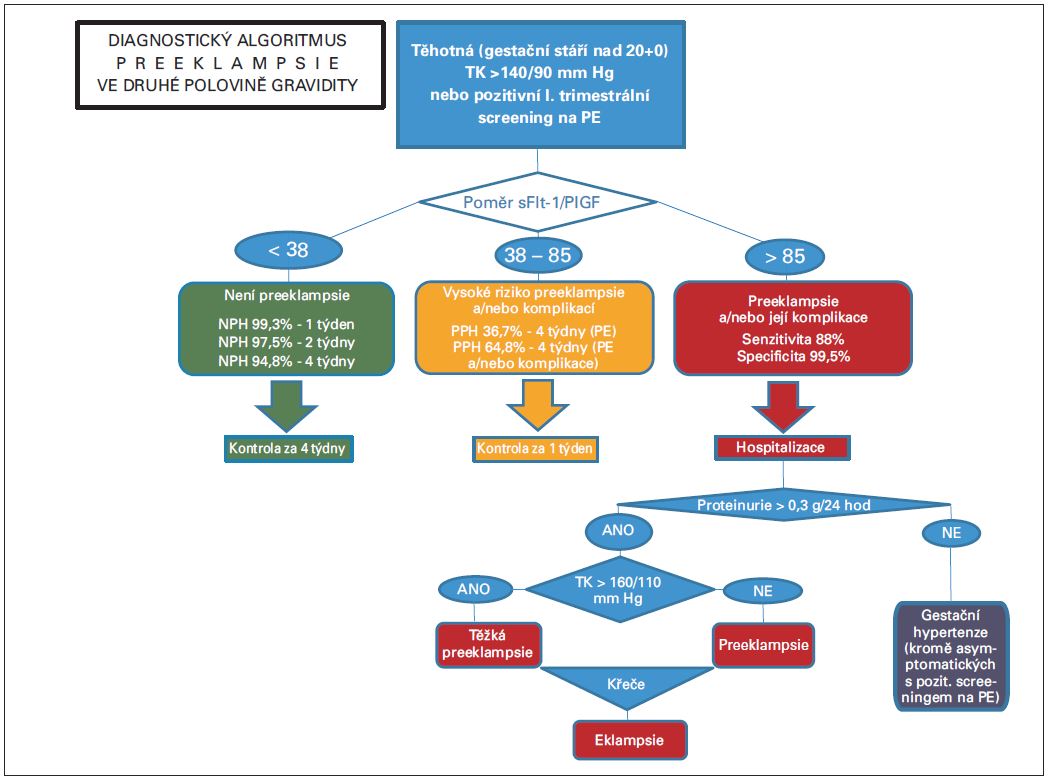
Dosud největší prospektivní, multicentrická studie PROGNOSIS, jejíž výsledky byly čerstvě publikované (21), si stanovila za cíl zjištění hraničních hodnot poměru sFlt-1/PlGF pro predikci rozvoje PE u těhotných s jednočetnou graviditou, se suspektní PE v rozmezí gestačního stáří 24 týdnů + 0 dnů až 36 týdnů + 6 dnů. Celkový počet sledovaných gravidit činil 1 050, primárním cílem bylo stanovení jednobodové hraniční hodnoty. Výsledky studie udávají klinicky použitelnou cut-off hodnotu 38 a poukazují na to, že při sFlt-1/PlGF < 38 je negativní prediktivní hodnota 99,3 %, se senzitivitou 80 % a specificitou 78,3 %. Pozitivní prediktivní hodnota při sFlt-1/PlGF > 38 činí 36,7 %, se senzitivitou 66,2 % a specificitou 83,1 %.
Pro jednodušší implementaci vyšetřování a používání poměru sFlt-1/PlGF do klinické praxe bylo ve spolupráci s předními světovými odborníky na tuto problematiku vypracované konsenzuální stanovisko (Tab. 2) aplikovatelné na následující dvě skupiny těhotných (22):
Autoři tohoto konsenzuálního stanoviska upozorňují na následující skutečnosti:
V případě těhotných s již diagnostikovanou PE (elevaci TK a proteinurii) měření poměru sFlt-1/PlGF nepřináší další diagnostické informace, ale může přispět k určování vážnosti a prognózy onemocnění.
Tab. 2 Doporučení pro management hodnot poměru sFlt-1/PlGF dle konsenzuálního stanoviska (22)
|
Poměr sFlt-1/PlGF |
Preeklampsie v době testování |
Riziko rozvoje preeklampsie |
Doporučení |
|
< 38 (více než 80% těhotných) |
není |
nízké (méně než 4% během dalšího týdne) |
- možno propustit do ambulantního sledování - další kontroly dle potřeby |
|
38 – 85 (časná PE) 38 – 110 (pozdní PE) |
není |
vysoké |
- při < 34+0 – kontrolní odběr za 1–2 týdny - při ≥ 34+0 – zvážit dřívější termín pro indukci porodu |
|
> 85 (časná PE) > 110 (pozdní PE) |
vysoce pravděpodobná PE nebo jiná placentární porucha |
velmi vysoké |
- dle místních doporučených postupů - opakování odběru za 2–4 dny pro sledování trendu dle uvážení lékaře a dle klinické závažnosti - extrémní hodnoty (> 655 v < 34+0 a > 201 v ≥ 34+0) spojené s nutností ukončení gravidity do 48 h - pečlivé monitorování a v případě < 34+0 zahájit indukci plicní zralosti |
Obr. 1 Diagnostický algoritmus preeklampsie ve druhé polovině gravidity (23)
PE je stále závažnou patologií těhotenství ohrožující život těhotných i plodů. Existence automatizovaných imunochemických testů Elecsys® (Roche Diagnostics) dovoluje rychlé vyhodnocení rizika rozvoje PE v krátkém časovém horizontu s pozoruhodnou a klinicky použitelnou negativní prediktivní hodnotou, dovolující hospitalizovat pouze těhotné se zvýšeným rizikem. Zatím však neexistuje žádná randomizovaná kontrolovaná studie, která by zkoumala pozitivní přínos vyšetření poměru sFlt-1/PlGF ve vztahu k mateřské a novorozenecké morbiditě a mortalitě.
Tento test (poměr sFlt-1/PlGF) by se měl provádět pouze u vysoce rizikovych těhotnych s hrozícím rozvojem PE. Za takové považujeme :
Cílená léčba PE je možná ovlivněním angiogenní dysbalance, ale jsou nutné větší randomizované studie k potvrzení efektivity a bezpečnosti těchto metod. Nové biomarkery PE (sFlt-1 a PlGF) mohou byt důležitým pomocníkem lékařů z hlediska její krátkodobé predikce a diagnostiky.
Podpořeno MZ ČR - RVO VFN64165.